题目内容
【题目】某化学课外活动小组设计实验探究氮的化合物的性质,装置如图所示,其中A(装置未画出)为气体发生装置。检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解。
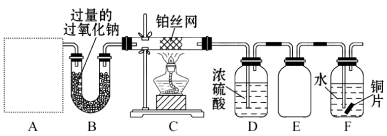
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填备选试剂的字母);
A.NH4HCO3 B.NH4Cl C.Ca(OH)2 D.NaOH
此时A中主要的玻璃仪器有 (填名称);
(2)对于C中发生的可逆反应,其方程式为: ;
有关该反应的下列说法中正确的是 。
A.增大一种反应物的浓度可以提高另一种反应物的转化率
B.工业上进行该反应时,可采取高压的条件提高反应物转化率
C.在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(3)E装置可防止F中溶液倒吸进入D中,请在上图中画出装置E中的导气管。
(4)写出F中发生反应的离子方程式: ;若进入F装置的物质成分和质量一定,可向F中加入下列物质(填字母)中的 使铜片溶解的质量增多。
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
【答案】(1)A 试管、酒精灯、导气管
(2)4NH3+5O2![]() 4NO+6H2O A
4NO+6H2O A
(3)![]()
(4)8H++2NO3-+3Cu=3Cu2++2NO↑+2H2O D
【解析】
试题分析:(1)由题意、装置图推断,A中所盛的一种试剂一定是碳酸氢铵,因为它受热分解生成氨气、水蒸气和CO2,水蒸气和CO2与过量过氧化钠反应生成氢氧化钠、碳酸钠和氧气,氨气与氧气在铂丝催化下反应生成NO和水蒸气,浓硫酸除去NO中的水蒸气;碳酸氢铵是固体反应物,且需要加热,因此A中主要玻璃仪器为试管、导气管、酒精灯;(2)C中发生了氨气的催化氧化:4 NH3 + 5 O2 ![]() 4 NO + 6 H2O;A、其它变量不变时,增大一种反应物的浓度,平衡右移,可以提高另一种反应物的转化率,A正确;B、工业上进行该反应时,不采用高压条件,而采用常温条件,因为增大压强时平衡向气体体积减小的逆反应方向移动,不能提高反应物的转化率,B错误;C、平衡浓度之比不一定等于化学方程式中的系数之比,而是由起始浓度和变化浓度决定,除非起始浓度之比等于4∶5,C错误;(3)E为安全瓶,因此进、出该装置的导气管都不需要太长;(4)F处铜片逐渐溶解的原理是8 H+ + 2 NO3- + 3 Cu = 3 Cu2+ +2 NO↑ + 2 H2O,因为NO、过量O2与水反应能生成稀硝酸;若进入F装置的物质成分和质量一定,则其中生成的硝酸铜含有硝酸根离子,该粒子在酸性条件下还能继续氧化单质铜,因此加入硫酸能使铜溶解质量增多。。
4 NO + 6 H2O;A、其它变量不变时,增大一种反应物的浓度,平衡右移,可以提高另一种反应物的转化率,A正确;B、工业上进行该反应时,不采用高压条件,而采用常温条件,因为增大压强时平衡向气体体积减小的逆反应方向移动,不能提高反应物的转化率,B错误;C、平衡浓度之比不一定等于化学方程式中的系数之比,而是由起始浓度和变化浓度决定,除非起始浓度之比等于4∶5,C错误;(3)E为安全瓶,因此进、出该装置的导气管都不需要太长;(4)F处铜片逐渐溶解的原理是8 H+ + 2 NO3- + 3 Cu = 3 Cu2+ +2 NO↑ + 2 H2O,因为NO、过量O2与水反应能生成稀硝酸;若进入F装置的物质成分和质量一定,则其中生成的硝酸铜含有硝酸根离子,该粒子在酸性条件下还能继续氧化单质铜,因此加入硫酸能使铜溶解质量增多。。

【题目】在一定条件下,X既能与Y反应又能与Z反应,且都属于复分解反应的是
选项 | X | Y | Z |
A | Cu | HNO3 | Fe(NO3)3 |
B | FeCl3 | Zn | NaHCO3 |
C | O2 | NH3 | SO2 |
D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
A. A B. B C. C D. D