题目内容
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产,回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出相应反应的化学方程式 。
(2)已知:
甲醇脱水反应 2CH3OH(g)═CH3OCH3(g) + H2O(g)△H1=﹣23.9kJmol﹣1
甲醇制烯烃反应 2CH3OH(g)═C2H4(g) + 2H2O(g)△H2=﹣29.1kJmol﹣1
乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=" +" 50.7kJmol﹣1
则乙烯气相直接水合反应C2H4(g) + H2O(g)═C2H5OH(g)的△H= kJmol﹣1,与间接水合法相比,气相直接水合法的优点是 ;
(3)气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中![]() :
:![]() =1:1)
=1:1)
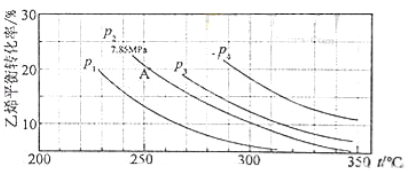
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= 。
(A点总压为7.85MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(P1,P2,P3,P4)大小顺序为 ,理由是 ;
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,![]() :
:![]() =0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
=0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。
【答案】C2H4+ H2SO4=C2H5OSO3H、C2H5OSO3H + H2O→C2H5OH + H2SO4
﹣45.5 无副产品,原子利用率100% 0.07(MPa)﹣1 p1<p2<p3<p4 正反应为气体分子数减少的反应,相同温度下,压强升高,平衡向正方向移动,乙烯转化率提高
将产物乙醇液化移去、 增加n(H2O):n(C2H4)的比值
【解析】试题分析:(1)根据题意可得乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)的方程式为C2H4+ H2SO4= C2H5OSO3H,硫酸氢乙酯发生水解反应得到乙醇,方程式为C2H5OSO3H + H2O=C2H5OH + H2SO4;
(2)根据盖斯定律可知:化学反应放出的能量多少与反应途径无关,而只与物质的开始状态及终止状态有关。将几个方程式进行叠加:①-②-③,整理可得C2H4(g) + H2O(g) = C2H5OH(g) , △H = (-23.9 + 29.1 - 50.7) KJ/mol = -45.5 KJ/mol;通过比较气相直接水合法和间接水合法使用的原料、产物可以发现:气相直接水合法具有污染小,腐蚀性小、无副产品,原子利用率100%等的优点;
(3)①乙烯水合制乙醇反应在图中A点的平衡常数
K (MPa)-1;
(MPa)-1;
②由方程式C2H4(g) + H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4;
③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变n(H2O):n(C2H4)比等。
【考点地位】本题主要是考查方程式书写、反应热计算、平衡状态计算及外界条件对平衡状态的影响等
【名师点晴】本题以乙醇的制取方法为线索考查化学反应原理、方程式的书写、化学平衡移动原理、物质制取方案的比较、反应条件的选择、盖斯定律的应用、反应热、化学平衡常数的计算的知识。考查学生综合运用所学化学知识解决相关化学问题的能力。体现了化学是一门实用性学科,从而提高学生学习化学的积极性和学习的兴趣。在一定程度上考查了学生的知识的灵活运用能力和分析问题解决问题的能力。