题目内容
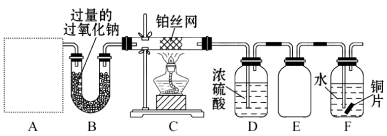
【题目】对于反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A. 只有硫酸铜作氧化剂
B. SO42-既不是氧化产物又不是还原产物
C. 被氧化的硫与被还原的硫的质量比为3∶7
D. 1 mol硫酸铜可以氧化![]() mol的硫
mol的硫
【答案】C
【解析】试题分析:A、该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为+6价、-2价,根据元素化合价知,部分FeS2和硫酸铜作氧化剂,A错误;B、因FeS2中部分S元素的化合价由-1升高到+6价,生成物中部分SO42-为氧化产物,B错误;C、由反应可知,10个S原子中,有3个S原子失去电子,7个S原子得到电子,即被氧化的硫与被还原的硫的质量比为3:7,C正确;D、1mol硫酸铜得到1mol电子,由电子守恒可知,氧化硫为![]() mol,D错误;答案选C。
mol,D错误;答案选C。

【题目】
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是______________(填仪器名称)。
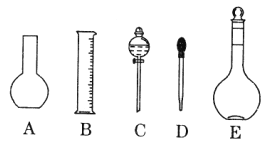
(2)容量瓶上需标有以下6项中的_________________(填序号)
① 温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
(3)容量瓶不_________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(4)根据计算用托盘天平称取NaOH的质量为__________g。需用量筒量取质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为:__________mL(计算结果保留一位小数)。在配制过程中,下列操作中能引起误差偏高的有____________(填代号)。
① 未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中定容
② 定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③ 定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④ 定容时,俯视刻度线
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阳离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成 18 电子的分子,该分子的结构式为 。
(2)R元素的单质与水反应的离子方程式是 。
(3)Z与Q相比,金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (填字母序号)。
a.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
b.Z与冷水反应迅速,而Q与冷水几乎不反应
c.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(4)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为 ,其中用于测定一些文物年代的核素的符号为 。
(5)写出Z2M2与X2M反应的化学方程式并标出电子转移关系。
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
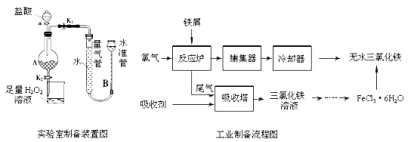
已知:(1)无水FeCl3的熔点为555K、沸点为588K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为。
(6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定过程中可能造成实验结果偏低的是
A.锥形瓶未润洗
B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
D.滴定终点时仰视读数
②样品中氯化铁的质量分数