题目内容
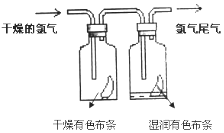
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式___________________。
(2)D中放入浓H2SO4其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论是________________________________。
(4)G处的现象是____________________________________。
(5)用化学方程式写出H处尾气吸收装置中的反应原理____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①消毒液与洁厕灵不能同时使用,原因是(用离子方程式表示)____________。
②需“密闭保存”的原因____________________________________________。
(7)工业上用亚氯酸钠和稀盐酸为原料制备 ClO2 ,写出反应的化学方程式____________。Cl2和ClO2都是强氧化剂,能杀死水中的病菌。等质量的ClO2的氧化能力是Cl2的_______倍。
(8)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,如:[(SCN)2+H2O = HSCN+HSCNO]。它们阴离子的还原性强弱为 Cl-<Br-<CN-<SCN-<I-。试写出:KBr和KSCN的混合溶液中加入(CN)2,反应的化学方程式为_________________。
【答案】MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 除去氯气中的水蒸气 E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性 出现蓝色 Cl2+2NaOH=NaCl+NaClO+H2O Cl+ClO+2H+===Cl2↑+H2O 次氯酸钠与空气中的二氧化碳反应 5NaClO2+4HCl= 4ClO2↑+5NaCl+2H2O 2.63 CN2+2KSCN===2KCN+(SCN)2
Mn2++Cl2↑+2H2O 除去氯气中的水蒸气 E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性 出现蓝色 Cl2+2NaOH=NaCl+NaClO+H2O Cl+ClO+2H+===Cl2↑+H2O 次氯酸钠与空气中的二氧化碳反应 5NaClO2+4HCl= 4ClO2↑+5NaCl+2H2O 2.63 CN2+2KSCN===2KCN+(SCN)2
【解析】
根据实验装置分析实验过程中涉及的化学反应及反应现象;根据物质的组成分析常见化学品的安全使用;根据氧化还原反应原理分析和书写化学方程式。
(1)浓盐酸与二氧化锰加热反应生成氯气,离子方程式为MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)根据实验装置图知,浓H2SO4其目的是除去氯气中的水蒸气,
故答案为:除去氯气中的水蒸气;
(3)E中为红色干布条,F中为红色湿布条,氯气和水反应生成次氯酸,而次氯酸具有强氧化性,有漂白作用,所以可观察到的现象是E中不褪色,F中褪色,对比E和F中现象的差异可得出的结论是干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性,
故答案为:E中不褪色,F中褪色;干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性;
(4)如图所示,生成的氯气与碘化钾溶液反应生成单质碘,淀粉遇碘变蓝,所以G处的现象是出现蓝色,
故答案为:出现蓝色;
(5)用氢氧化钠溶液吸收氯气,反应为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)①消毒液与洁厕灵不能同时使用,原因是发生了化学反应,离子方程式为:Cl+ClO+2H+===Cl2↑+H2O,
故答案为:Cl+ClO+2H+===Cl2↑+H2O;
②需“密闭保存”的原因是次氯酸钠与空气中的二氧化碳反应,
故答案为:次氯酸钠与空气中的二氧化碳反应;
(7)亚氯酸钠NaClO2中Cl元素化合价为+3价, NaClO2→ClO2,+3价的氯元素化合价升高到+4价,NaClO2→NaCl,+3价的氯元素的化合价降低到-1价,NaClO2在反应中既是氧化剂又是还原剂,根据电子守恒,得到方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O; 氧化能力是得电子的能力,根据氯元素的化合价,等质量的ClO2和Cl2的得电子数之比为:![]() 5:
5:![]() ×2,即2.63,所以等质量的ClO2的氧化能力是Cl2的2.63倍,
×2,即2.63,所以等质量的ClO2的氧化能力是Cl2的2.63倍,
故答案为:2.63;
(8)阴离子的还原性越弱,则其对应分子的氧化性越强,氧化性强的可以置换出氧化性弱的,故CN2可以置换出(SCN)2,根据Cl2+2KBr=2KCl+Br2进行迁移应用,反应的化学方程式为CN2+2KSCN===2KCN+(SCN)2,
故答案为:CN2+2KSCN===2KCN+(SCN)2。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】某课外学习小组在学习了![]() 与
与![]() 的反应后,认为
的反应后,认为![]() 与
与![]() 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究
进行实验,探究![]() 与
与![]() 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。

Ⅰ![]() 写出装置A中发生反应的化学方程式:______。
写出装置A中发生反应的化学方程式:______。
Ⅱ![]() 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的![]() 、水蒸气等进入C中与
、水蒸气等进入C中与![]() 反应,还可以______________________________________________________。
反应,还可以______________________________________________________。
Ⅲ![]() 在通入足量的
在通入足量的![]() 与
与![]() 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有![]() ;
;
假设2:___________;
假设3:既有![]() ,又有
,又有![]() 。
。
(1)若假设2成立,写出![]() 与
与![]() 反应的化学方程式:_________________。
反应的化学方程式:_________________。
(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
步骤![]() 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性![]() 溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。
溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。![]() 选填1、2或
选填1、2或![]()