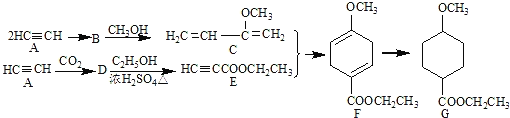题目内容
【题目】将Na2CO3和NaHCO3的混合物5.48g加热到质量不再减轻时,测得残留固体4.24g。另取一定质量的此混合物固体,跟 100 mL某浓度的盐酸刚好完全反应,并收集到 672 mL CO2气体(标准状况下),求;
(l)此混合物中NaHCO3的质量分数____;
(2)所用盐酸的物质的量浓度____。
【答案】61.3%0.4mol·L-1
【解析】
(1)固体加热时发生2NaHCO3==Na2CO3+CO2↑+H2O反应,利用差量法可计算原混合物中NaHCO3质量,进而计算碳酸氢钠的质量分数。
(2) Na2CO3和NaHCO3的混合物逐滴加盐酸过程中,碳酸钠先与盐酸发生Na2CO3+HCl== NaCl+NaHCO3反应,可以计算出盐酸的消耗量;然后发生NaHCO3+HCl==NaCl+CO2↑+H2O反应,根据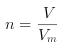 计算反应生成的二氧化碳的物质的量,结合反应方程式计算出消耗盐酸的量,计算出两个反应消耗盐酸的总量,进而根据
计算反应生成的二氧化碳的物质的量,结合反应方程式计算出消耗盐酸的量,计算出两个反应消耗盐酸的总量,进而根据![]() 计算出盐酸的浓度。
计算出盐酸的浓度。
(1)设混合物中含NaHCO3的质量为x;
2NaHCO3==Na2CO3+CO2↑+ H2O质量减少△m
2×84 106 62
x 5.48-4.24
列方程计算出x=2×84×(5.48-4.24)/62=3.36g;ω(NaHCO3)=3.36g/5.48g×100%=61.3%;正确答案:61.3%。
(2)由(1)的计算结果可知:n(NaHCO3)=3.36/84=0.04mol,n(Na2CO3)=(5.48-3.36)/106=0.02mol;根据反应进行计算:根据Na2CO3+HCl== NaCl+NaHCO3可知消耗盐酸0.02 mol;碳酸钠和碳酸氢钠混合物与盐酸反应共产生二氧化碳的量672×10-3/22.4=0.03mol,
根据NaHCO3+HCl== NaCl+CO2↑+H2O反应可知,消耗盐酸的量为0.03 mol,两个反应共消耗盐酸的总量为0.01+0.03=0.04mol, 所用盐酸的物质的量浓度为0.04/0.1=0.4mol·L-1;正确答案:0.4mol·L-1。