题目内容
【题目】(1)p电子的原子轨道呈______形;
(2)共价键的类型有两种分别是σ键和π键,σ键的对称方式为______;
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是______,最高价氧化物对应的水化物的化学式______;
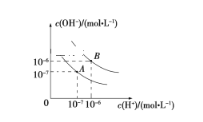
(4)用“>”或“<”填空:①能量:4p______5s②离子半径:F-______Na+;
(5)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
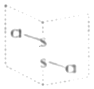
①S2Cl2的结构式为______,其化学键类型有______(填“极性键”“非极性键”或“极性键和非极性键”)。
②电负性:S______Cl(填“>”或“<”),每个S原子有______对弧电子对。
【答案】哑铃 轴对称 As H3AsO4 < > Cl-S-S-Cl 极性键和非极性键 < 2
【解析】
(1)p电子的原子轨道呈哑铃型;
(2)σ键以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴呈圆柱形分布的;
(3)位于元素周期表中第四周期,第VA族的元素为As元素,据此解答;
(4)根据能级交错现象分析判断;电子层数相同的核电荷数越大,离子半径越小;
(5)①根据S2Cl2的空间结构书写结构式,结合共价键的分类分析解答;
②元素的非金属性越强,电负性越强;根据硫的原子结构结合S2Cl2的结构式判断S的孤对电子对数。
(1)p电子的原子轨道呈哑铃型,三维空间分别为px、py、pz,故答案为:哑铃;
(2)σ键以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴对称,故答案为:轴对称;
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是As,最高价氧化物对应的水化物的化学式H3AsO4,故答案为:As;H3AsO4;
(4)①根据能级交错现象,能量:4p<5s;②相同电子层数的离子,核电荷数越大离子半径越小:F->Na+,故答案为:<;>;
(5)①根据S2Cl2的空间结构可知,其结构式为Cl-S-S-Cl,含有极性键Cl-S和非极性键S-S键,故答案为:Cl-S-S-Cl;极性键和非极性键;
②元素吸电子能力越强,非金属性越强,其电负性越强,非金属性S<Cl,电负性S<Cl;S2Cl2的结构式为Cl-S-S-Cl,硫原子最外层有6个电子,形成了2个σ键,还含有2对孤对电子对,故答案为:<;2。