题目内容
16.一块质量为4g的合金,与足量的盐酸反应完全后生成氢气0.2g,则该合金可能是( )| A. | 铁镁合金 | B. | 铁铜合金 | C. | 铁锌合金 | D. | 镁铝合金 |
分析 假设金属和酸反应后都生成+2价,n(H2)=0.2g2g/mol=0.1mol,+2价金属和酸反应生成氢气时,金属和氢气的物质的量相等,则合金¯M=4g0.1mol=40g/mol,Al换算为+2价时其摩尔质量为18g/mol,和稀盐酸不反应的金属其摩尔质量无穷大,两种金属一种金属摩尔质量大于40g/mol一个小于40g/mol即可,据此分析解答.
解答 解:假设金属和酸反应后都生成+2价,n(H2)=0.2g2g/mol=0.1mol,+2价金属和酸反应生成氢气时,金属和氢气的物质的量相等,则合金¯M=4g0.1mol=40g/mol,Al换算为+2价时其摩尔质量为18g/mol,和稀盐酸不反应的金属其摩尔质量无穷大,两种金属一种金属摩尔质量大于40g/mol一个小于40g/mol即可,
A.Fe的摩尔质量为56g/mol、Mg的摩尔质量为24g/mol,符合条件,故A正确;
B.Fe的摩尔质量为56g/mol、Cu的摩尔质量无穷大,都大于40g/mol,不符合条件,故B错误;
C.Fe的摩尔质量为56g/mol、Zn的摩尔质量为65g/mol,都大于40g/mol,不符合条件,故C错误;
D.Mg的摩尔质量是24g/mol、Al(+2)的摩尔质量是18g/mol,都小于40g/mol,不符合条件,故D错误;
故选A.
点评 本题考查混合物有关计算,侧重考查学生分析计算能力,采用平均摩尔质量法分析解答即可,注意Cu、Al金属摩尔质量的处理方法,为易错点.

练习册系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 除去CO2中的SO2:SO2+CO32-═CO2↑+SO32- | |
| C. | 0.01 mol SO2气体通入10 mL 1 mol/L的NaOH溶液中:SO2+OH-═HSO3- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
4.使用单质铜制取硝酸铜,最适宜的方法是:( )
| A. | Cu+稀HNO3 | B. | Cu空气、△→CuO硝酸→Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | CuCl2→CuCl2AgNO3→Cu(NO3)2 |
11.如图实验不能达到目的是( )
| A. | 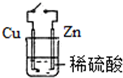 原电池能加快反应速率 | B. | 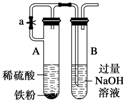 制备Fe(OH)2 | ||
| C. | 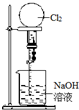 喷泉实验 | D. | 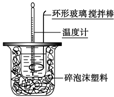 中和热的测定 |
1.下列物质中,属于纯净物的是( )
| A. | 石灰水 | B. | 空气 | C. | 生铁 | D. | 水 |
8.许多城市都限制燃放烟花爆竹,除噪声污染外,爆竹燃放时会产生一种无色有刺激性气味、有毒的气体,这种气体是( )
| A. | N2 | B. | SO2 | C. | CO2 | D. | C12 |
5.2010年诺贝尔物理奖授予发现石墨烯的开创性研究者,金刚石、石墨、C60和石墨烯的结构示意图分别如下图所示,下列说法不正确的是( )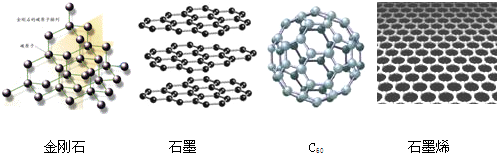

| A. | 金刚石和石墨烯中碳原子的杂化方式不同 | |
| B. | 金刚石、石墨、C60 和石墨烯的关系:互为同素异形体 | |
| C. | 这四种物质完全燃烧后的产物都是CO2 | |
| D. | 石墨与C60的晶体类型相同 |
3.下列对有机物结构或性质的描述,错误的是( )
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 聚乙烯不能使酸性高锰酸钾褪色 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 丙烯与水加成反应的产物存在同分异构体 |
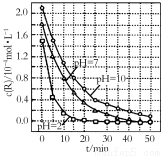
 强,R的降解速率越小
强,R的降解速率越小