题目内容
9.依据图判断,下列说法正确的是( )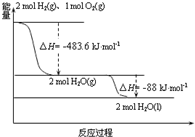
| A. | 氢气的燃烧热为△H=-241.8 kJmol-1 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | H2O(l)分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比 2 mol H2O(g)所具有的总能量低 |
分析 A.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量;
B.H2O(g)生成H2O(l)时,放出热量,故断键吸收的能量小于成键放出的能量;
C.液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g),△H=+(483.6+88)=+571.6kJ•mol-1;
D.2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出483.6kJ的热量,故2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高.
解答 解:A.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量,故氢气的燃烧热为$\frac{483.6+88}{2}$=285.8kJ•mol-1,故A错误;
B.H2O(g)生成H2O(l)为物理变化,不存在化学键的断裂和生成,故B错误;
C.液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g),△H=+(483.6+88)=+571.6kJ•mol-1,故C正确;
D.2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出483.6kJ的热量,故2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高,故D错误;
故选C.
点评 本题考查化学反应能量变化分析,主要是能量守恒和反应实质的理解应用,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为( )
| A. | c(CH3COO-)<c(Na+) | B. | c(OH-)>c(H+) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COOH)+c (CH3COO-)=0.02mol/L |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA | |
| C. | 标准状况下,2.24L的苯中含有的σ键数为1.2NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ |
14.下列说法正确的是( )
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯 | |
| B. | 分子式为C4H8Cl2结构中含一个-CH3的同分异构体(不考虑立体异构)有5种 | |
| C. | 1mol乙酰水杨酸( )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 可用 和HCHO为原料合成 和HCHO为原料合成 |
1.下列各组有机物中,无论以何种比例混合,只要二者物质的量之和不变,完全燃烧时消耗O2的物质的量和生成H2O的物质的量保持不变的是( )
| A. | 乙烯、丙烯酸(CH2=CH-COOH) | B. | 乙酸、甲醛(HCHO) | ||
| C. | 甲烷、乙二醇(HOCH2CH2OH) | D. | 乙烷、乙醇 |
18.在一定温度下,一定量的水中,Mg(OH)2悬浊液里有如下平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),当向混合物中加入少量粉末状MgO时,下列说法正确的是( )
| A. | Mg2+的数目减少 | B. | Mg2+的浓度增大 | ||
| C. | 溶液pH不变 | D. | Mg(OH)2固体质量不变 |
 )、④甲苯(
)、④甲苯(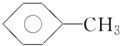 ),
), .此反应属于取代反应.
.此反应属于取代反应.