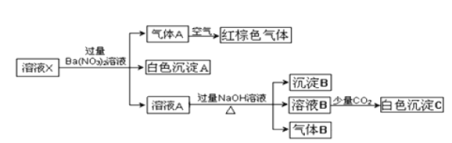
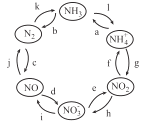
题目内容
【题目】(1)请用平衡移动原理解释Na2CO3能使溶液中Fe3+转化成氢氧化物沉淀的原因_______。
(2)取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度(溶液的体积变化忽略不计)为____________。
(3)常温下,将0.1 mol·L-1 的氨水与0.1 mol·L-1的盐酸按一定体积混合。若两溶液混合后,所得溶液中 c(NH4+)=c(Cl-),混合后所得溶液中溶质的电离方程式为_______;水解离子方程式为_______。
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+) : c(Cu2+) =___________。
【答案】因Fe3++3H2O= Fe(OH)3+3H+水解显酸性,加入碳酸钠后,H+与CO32-反应,使水解平衡右移动从而产生沉淀 0.05mol/L NH3![]() H2O
H2O ![]() NH4+ +OH- NH4++H2O
NH4+ +OH- NH4++H2O![]() NH3
NH3![]() H2O+H+ 1:2
H2O+H+ 1:2![]() 10-21
10-21
【解析】
(1)根据影响水解因素进行分析;
(2)根据酸碱混合溶液pH的计算进行求解;
(3)根据弱碱和强酸混合后溶液呈中性分析溶解液的成分,在进行相关反应方程式书写;
(4)根据Ksp(FeS)>Ksp(CuS)分析产生相应沉淀的各离子浓度进行计算。
(1) 因为Fe3+水解导致溶液呈酸性,其水解反应离子方程式为:Fe3++3H2O= Fe(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁沉淀,故答案为:因Fe3++3H2O![]() Fe(OH)3+3H+水解显酸性,加入碳酸钠后,H+与CO32-反应,使水解平衡右移动从而产生沉淀;
Fe(OH)3+3H+水解显酸性,加入碳酸钠后,H+与CO32-反应,使水解平衡右移动从而产生沉淀;
(2)设原溶液物质的量浓度为cmol/L,V[NaOH(aq)]=3L,V[HCl(aq)]=2L,二者混合后反应,混合溶液体积为5L,二者混合后反应所得溶液pH=12,则c(OH-)=10-2mol/L,则:3L![]() cmol/L-2L
cmol/L-2L![]() cmol/L==10-2mol/L
cmol/L==10-2mol/L![]() 5L,解得:c=0.05mol/L,故答案为:0.05mol/L;
5L,解得:c=0.05mol/L,故答案为:0.05mol/L;
(3)若氨水与盐酸混合后所得溶液中c(NH4+)=c(Cl-),根据电荷守恒有c(H+)=c(OH-),溶液呈中性,氨水过量,溶液中存在铵根离子的水解平衡NH4++H2O![]() NH3
NH3![]() H2O+H+,一水合氨的电离平衡NH3
H2O+H+,一水合氨的电离平衡NH3![]() H2O
H2O ![]() NH4+ +OH-,故答案:NH3
NH4+ +OH-,故答案:NH3![]() H2O
H2O ![]() NH4+ +OH-
NH4+ +OH-
;NH4++H2O![]() NH3
NH3![]() H2O+H+
H2O+H+
(4)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,反应的离子方程式为S2-+Cu2+=CuS↓。当加入Na2S溶液至出现两种沉淀,此时c(S2-)=![]() = 6.5
= 6.5![]() 10-17mol/L,c(Cu2+) =
10-17mol/L,c(Cu2+) =![]() = 2
= 2![]() 10-20mol/L,则c(Fe2+):c(Cu2+)=0.1:2
10-20mol/L,则c(Fe2+):c(Cu2+)=0.1:2![]() 10-20=1:2
10-20=1:2![]() 10-21。
10-21。

【题目】水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是重要的饮用水源,污染物通过饮用水可直接毒害人体。也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为________,由水电离出的c(OH-)=_______mol/L
(2)纯水在100℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的 c(OH-)=_______mol/L。
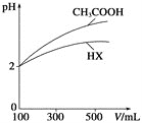
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数___(填”大于””小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K==1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.610-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为______
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中 c(CH3COO-)-c(Na+)=_____(填精确值)mol/L
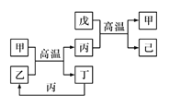
【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
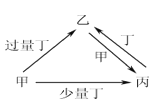
选项 | 甲 | 乙 | 丙 | 丁 |
A | NaOH | NaHSO3 | Na2SO3 | SO2 |
B | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
C | C | CO2 | CO | O2 |
D | Al | NaAlO2 | Al(OH)3 | NaOH |
A. A B. B C. C D. D