题目内容
【题目】若用AG来表示溶液的酸度,其表达式为:AG=lg[![]() ]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
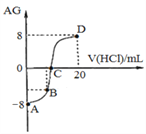
A. 该滴定实验最好选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大
D. 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH)
【答案】D
【解析】A、 0.1 mol/L 的MOH溶液,AG=-8,AG=lg[![]() ],
],![]() =10-8,c(H+)C(OH― )=10-14,C(OH― )=10-3mol/L,MOH为弱碱,恰好反应时溶液显酸性,选甲基橙作指示剂,故A错误;B、AG=0时,c(H+)=C(OH― )=10-7,溶液呈中性时,溶液的中所加HCl小于10mL,故B错误;C、滴定过程中从A点到D点,溶液中水的电离程度先逐渐变大,后逐渐减小,故C错误;D、若B点加入的盐酸溶液体积为5mL,则所得溶液中含等物质量的MOH、MCl,根据质子守恒有:c(M+)+2c(H+)=c(MOH)+2c(OH),或根据电荷守恒和物料守恒两式加减消元消去Na+ 的浓度,故D正确;故选D。
=10-8,c(H+)C(OH― )=10-14,C(OH― )=10-3mol/L,MOH为弱碱,恰好反应时溶液显酸性,选甲基橙作指示剂,故A错误;B、AG=0时,c(H+)=C(OH― )=10-7,溶液呈中性时,溶液的中所加HCl小于10mL,故B错误;C、滴定过程中从A点到D点,溶液中水的电离程度先逐渐变大,后逐渐减小,故C错误;D、若B点加入的盐酸溶液体积为5mL,则所得溶液中含等物质量的MOH、MCl,根据质子守恒有:c(M+)+2c(H+)=c(MOH)+2c(OH),或根据电荷守恒和物料守恒两式加减消元消去Na+ 的浓度,故D正确;故选D。

【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是 ( )
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
