题目内容
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:

①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化示意图如图:
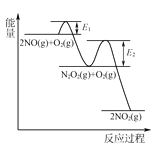
Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
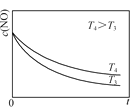
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:
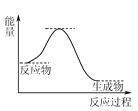
研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。
【答案】-746.5 c 催化剂失去活性 Ⅱ T4 ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小,浓度降低的影响大于温度对反应Ⅱ速率的影响 4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
【解析】
(1)根据盖斯定律,目标方程式ΔH=-ΔH1+2ΔH2-ΔH3=-746.5kJ·mol-1;
(2)①n(NH3):n(NO)的物质的量之比为1:3时,由于NH3所占有的百分含量较小,虽然NO占有的百分含量很大,但是消耗NO的量较小,导致NO的脱除率较低,故c曲线正确;
②温度升高到一定程度以后,NO的脱除率会下降,因为反应过程中加入了催化剂,温度过高催化剂失活,导致NO脱除率降低;
(3)①反应Ⅰ的活化能较反应Ⅱ的活化能低一些,反应速率也较快一下,故反应Ⅱ为整个反应的决定步骤;
②转化相同量的NO,T4温度下消耗的时间较长;原因为:反应的ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小,浓度降低的影响大于温度对反应Ⅱ速率的影响;
(4)根据题目所给的示意图,可以得出NH3、NO、O2参加反应生成N2和H2O,故脱硝过程的总反应为4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)。
4N2(g)+6H2O(g)。

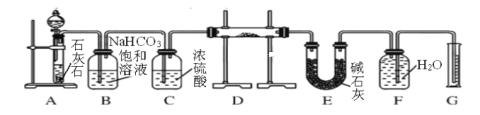
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
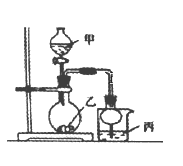
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 淀粉—KI溶液 | 溶液变蓝 |
C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
A.AB.BC.CD.D