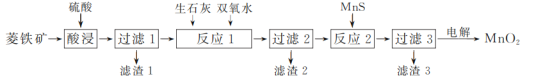
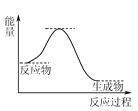
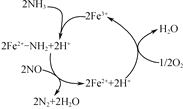
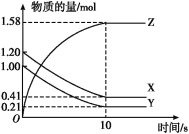
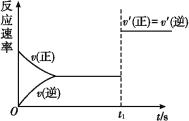
题目内容
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
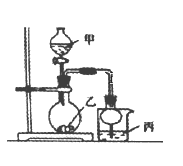
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 淀粉—KI溶液 | 溶液变蓝 |
C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
A.AB.BC.CD.D
【答案】B
【解析】
A.二氧化硫的水溶液显酸性,则石蕊变红,二氧化硫不能漂白石蕊,则溶液不褪色,A错误;
B.高锰酸钾与浓盐酸反应制取氯气,氯气与碘化钾反应生成碘单质,遇到淀粉显蓝色,B正确;
C.二氧化碳与氯化钡不反应,则无白色沉淀生成,C错误;
D.氨气与氯化铝反应生成氢氧化铝沉淀,氢氧化铝不与氨水反应,则沉淀不消失,D错误;
答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=_____________。
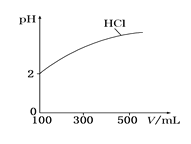
(2)体积均为100 mL、pH均为2的盐酸与一元弱酸HX,加水稀释过程中盐酸的pH与溶液体积的关系如图所示,则在图上画出HX加水至500mL稀释过程中pH值的变化曲线_____,并说明理由___________。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的_____倍。
(4)写出在NaCN溶液中通入少量CO2反应的离子方程式________________________。
(5)某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析合理的是___________。
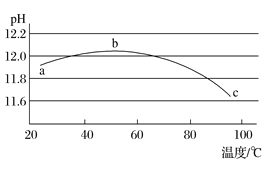
A 碳酸钠水解是吸热反应 B ab段说明水解平衡向右移动
C bc段说明水解平衡向左移动 D 水的电离平衡也对pH产生影响