题目内容
10.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 |
分析 A、pH=12的Na2CO3溶液中c(H+)=10-12mol/L,根据水的离子积计算溶液中c(OH-),再根据n=cV计算n(OH-),根据N=nNA计算OH-离子数目;
B、浓硫酸随着反应的进行会变成稀硫酸,稀硫酸不与铜反应,则反应生成的二氧化硫减少;
C、羟基不显电性;
D、氢气所处的状态不明确.
解答 解:A、pH=12的Na2CO3溶液中c(H+)=10-12mol/L,故溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$=0.01mol/L,溶液中n(OH-)=10L×0.01mol/L=0.1mol,OH-离子数目为0.2mol×NAmol-1=0.1NA,故A正确;
B、50mL 18.4mol/L的浓硫酸中H2SO4的物质的量=0.05L×18.4mol/L=0.92mol,若硫酸完全反应,由方程式可知生成二氧化碳的物质的量=0.92mol×$\frac{1}{2}$=0.46mol,由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应,故实际得到SO2小于0.46mol,故B错误;
C、羟基不显电性,故1mol羟基含9mol电子,故C错误;
D、氢气所处的状态不明确,不一定是标况,故物质的量不一定是2.24L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.Cu2O是一种红色或黄色的粉末,在工业上可用作有机合成催化剂或电子工业材料等.
(1)工业上可以用Na2SO3 还原CuSO4 的方法制备Cu2O,反应控制的温度为100℃~105℃,pH为3.5~5.5,其反应的化学方程式为2CuSO4+3Na2SO3═Cu2O+3Na2SO4+2SO2↑.也可以用电解法制备,电解时以铜作阳极,氢氧化钠为电解质溶液,写出电解时阳极发生的电极反应:2Cu-2e-+2OH-=Cu2O↓+H2O.
(2)某同学在实验室发现了一瓶使用过的红色粉末,且实验室中只有Fe2O3 和Cu2O两种颜色为红色的试剂,因此他就通过实验来探究该红色粉末的成分,已知Cu2O是一种碱性氧化物,溶于稀H2SO4生成Cu和CuSO4 ,在空气中加热生成CuO.
①请完成Cu2O与稀H2SO4反应的化学方程式:
Cu2O+H2SO4═Cu+CuSO4 +H2O;
②提出合理的假设:
假设1:红色粉末是Fe2O3 ;
假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3 和Cu2O的混合物.
③设计探究实验:
共选择的试剂:3mol•L-1 稀H2SO4、1mol•L-1 NaOH溶液、20%的KSCN溶液,3%的H2O2 溶液,稀HNO3、光亮的铁丝.
(1)工业上可以用Na2SO3 还原CuSO4 的方法制备Cu2O,反应控制的温度为100℃~105℃,pH为3.5~5.5,其反应的化学方程式为2CuSO4+3Na2SO3═Cu2O+3Na2SO4+2SO2↑.也可以用电解法制备,电解时以铜作阳极,氢氧化钠为电解质溶液,写出电解时阳极发生的电极反应:2Cu-2e-+2OH-=Cu2O↓+H2O.
(2)某同学在实验室发现了一瓶使用过的红色粉末,且实验室中只有Fe2O3 和Cu2O两种颜色为红色的试剂,因此他就通过实验来探究该红色粉末的成分,已知Cu2O是一种碱性氧化物,溶于稀H2SO4生成Cu和CuSO4 ,在空气中加热生成CuO.
①请完成Cu2O与稀H2SO4反应的化学方程式:
Cu2O+H2SO4═Cu+CuSO4 +H2O;
②提出合理的假设:
假设1:红色粉末是Fe2O3 ;
假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3 和Cu2O的混合物.
③设计探究实验:
共选择的试剂:3mol•L-1 稀H2SO4、1mol•L-1 NaOH溶液、20%的KSCN溶液,3%的H2O2 溶液,稀HNO3、光亮的铁丝.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量红色粉末于试管中,并加入过量3mol•L-1 稀H2SO4,充分反应后,将上层清液分成两份 | (1)若有红色固体剩余,则假设2,3可能成立; (2)若无红色固体剩余,则假设1,3可能成立 |
| 若步骤1中有红色固体剩余; 步骤2:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液仍为蓝色,则假设2成立; |
| 若步骤1中有红色固体剩余; 步骤3:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液变为血红色,则假设3成立. |
1.下列关于氨的叙述正确的是( )
| A. | 可用向上排空气法收集氨气 | |
| B. | 氨气极易溶于水,因此加热浓氨水不会产生氨气 | |
| C. | 将两根分别蘸有浓氨水和浓硫酸的玻璃棒靠近时,有白烟产生 | |
| D. | 在实验室中,可用加热氢氧化钙和氯化铵的固体混合物的方法制取氨气 |
5.下列物质的性质比较,正确的是( )
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S | D. | 气态氢化物稳定性:HCl>H2S |
15.某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下

下列有关推断合理的是( )

下列有关推断合理的是( )
| A. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 | |
| B. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ |
2.下列有关化学实验操作的说法不合理的是( )
| A. | 在配制FeSO4溶液时常向其中加入一定量铁粉和稀硫酸 | |
| B. | 用广泛pH试纸测量得某溶液的pH=13 | |
| C. | 用碱式滴定管量取20.00mL0.1000mol/LKmnO4溶液 | |
| D. | 实验室可将铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜以节约药品、减少污染 |
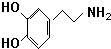 )是人体大脑中的一种有机物质叫做多巴胺.
)是人体大脑中的一种有机物质叫做多巴胺.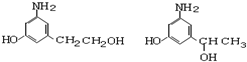 .
. 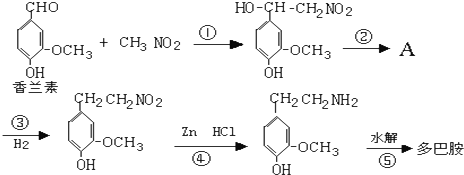
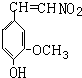 .
.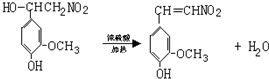 ,⑤:
,⑤: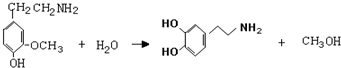 .
.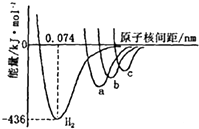 如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.
如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.

