题目内容
2.下列有关化学实验操作的说法不合理的是( )| A. | 在配制FeSO4溶液时常向其中加入一定量铁粉和稀硫酸 | |
| B. | 用广泛pH试纸测量得某溶液的pH=13 | |
| C. | 用碱式滴定管量取20.00mL0.1000mol/LKmnO4溶液 | |
| D. | 实验室可将铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜以节约药品、减少污染 |
分析 A.硫酸亚铁溶液中亚铁离子水解生成氢氧化亚铁和氢离子,易被空气中的氧气氧化为铁离子;
B.广泛pH试纸测量值为整数;
C.KmnO4溶液具有强氧化性能腐蚀碱式滴定管;
D.Cu与浓硫酸反应会生成二氧化硫.
解答 解:A.为防止亚铁离子被氧化和亚铁离子水解,配制溶液中加入铁粉防止亚铁离子被氧化,加入稀硫酸防止亚铁离子水解浑浊,故A正确;
B.广泛pH试纸测量值为整数,则用广泛pH试纸测量得某溶液的pH=13,故B正确;
C.KmnO4溶液具有强氧化性能腐蚀碱式滴定管,所以应该用酸式滴定管量取20.00mL0.1000mol/LKmnO4溶液,故C错误;
D.Cu与浓硫酸反应会生成二氧化硫,会污染空气,将铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜以节约药品、减少污染,故D正确.
故选C.
点评 本题考查了实验基本操作的分析应用,注意积累实验知识,掌握基本操作规范,是解题关键,题目难度不大.

练习册系列答案
相关题目
12.热化学方程式中化学式前的系数表示的是( )
| A. | 分子个数 | B. | 原子个数 | C. | 物质的质量 | D. | 物质的量 |
10.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 |
17.下列说法正确的是( )
| A. | 硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 医药中,常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性 | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 |
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| B. | 60gSiO2中含有NA个SiO2分子 | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA | |
| D. | 1molFe与1mol氯气反应转移3NA个电子 |
11.下列有关离子(或物质)的检验及结论,正确的是( )
| A. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体 | |
| B. | 焰色反应实验时,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 欲证明某溶液中含有Fe3+,滴加KSCN溶液,可观察到溶液会变为血红色 | |
| D. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO${\;}_{4}^{2-}$ |
12.以下物质间的每步转化中,有不能通过一步反应实现的是( )
| A. | SO2→SO3→H2SO4 | B. | Al2O3→Al(OH)3→NaAlO2 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | CH2=CH2→CH3CH2OH→CH3CHO |
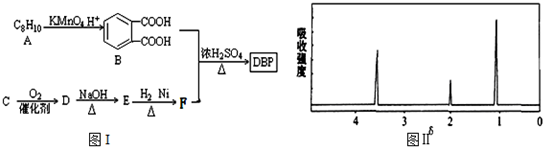
 $\stackrel{KMnO_{4}.H+}{→}$
$\stackrel{KMnO_{4}.H+}{→}$
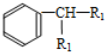
 +H2O(-R1、R2表示氢原子或烃基)
+H2O(-R1、R2表示氢原子或烃基) ,反应类型为取代反应
,反应类型为取代反应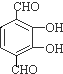 、
、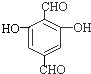 等.
等.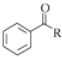 $→_{(S)-CBS}^{邻苯二酚硼烷}$
$→_{(S)-CBS}^{邻苯二酚硼烷}$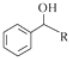 .根据已有知识并结合相关信息,写出以
.根据已有知识并结合相关信息,写出以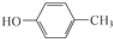 和CH3COOH为原料制备
和CH3COOH为原料制备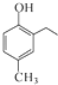 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.