题目内容
18.如图(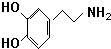 )是人体大脑中的一种有机物质叫做多巴胺.
)是人体大脑中的一种有机物质叫做多巴胺.(1)请写出多巴胺分子式:C8H11NO2.
(2)核磁共振氢谱显示其分子中含有8种氢原子.
(3)试判断多巴胺不能发生的化学反应D.
A.加成 B.取代 C.氧化 D.水解
(4)多巴胺有许多同分异构体,要满足以下条件:
a.属于1、3、5三取代苯.
b.苯环上直接连有一个羟基和一个氨基.
c.分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1.
写出所有满足以上条件同分异构体的结构简式:
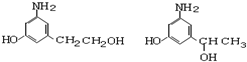 .
. (5)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得.合成过程表示如下:
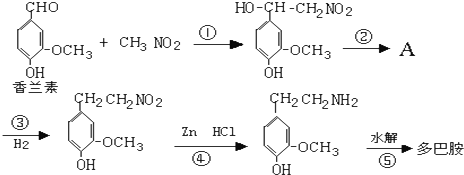
Ⅰ.写出反应类型:反应①取代反应,反应②消去反应.
Ⅱ、A的结构简式:
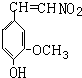 .
.Ⅲ、写出②、⑤两步的化学方程式:
②:
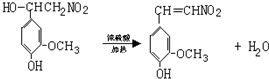 ,⑤:
,⑤: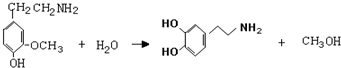 .
.
分析 (1)根据有机物的结构简式判断所含的元素种类和原子个数,可确定有机物的分子式;
(2)多巴胺分子有8种化学环境不同的H原子;
(3)多巴胺分子中含有酚羟基,可发生取代、氧化反应,含有氨基,具有碱性;
(4)多巴胺的同分异构体符合:分别能与钠和氢氧化钠反应,且消耗钠与氢氧化钠的物质的量之比为2:1,说明分子中含有1个醇羟基和1个酚羟基,属于1、3、5三取代苯且苯环上直接连有一个羟基和一个氨基,则另外取代基为-CH2CH2OH或-CH(OH)CH3;
(5)香兰素和硝基甲烷发生加成反应生成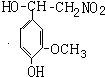 ,
, 反应生成A,A和氢气加成生成
反应生成A,A和氢气加成生成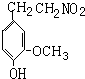 ,对比
,对比 和
和 可知,
可知, 先发生消去反应生成A,A再和氢气发生加成反应生成
先发生消去反应生成A,A再和氢气发生加成反应生成 ,所以A的结构简式为
,所以A的结构简式为 ,
, 和Zn、HCl发生还原反应生成
和Zn、HCl发生还原反应生成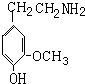 ,
,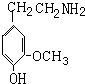 发生水解也是取代反应生成多巴胺,同时还生成甲醇.
发生水解也是取代反应生成多巴胺,同时还生成甲醇.
解答 解:(1)由多巴胺的结构简式,可知分子式为C8H11NO2,故答案为:C8H11NO2;
(2)多巴胺分子有8种化学环境不同的H原子,故答案为:8;
(3)多巴胺中含有酚羟基,可发生取代、氧化反应,含有氨基,具有碱性,且苯环可与氢气发生加成反应,不能发生水解反应,故答案为:D;
(4)多巴胺的同分异构体符合:分别能与钠和氢氧化钠反应,且消耗钠与氢氧化钠的物质的量之比为2:1,说明分子中含有1个醇羟基和1个酚羟基,属于1、3、5三取代苯且苯环上直接连有一个羟基和一个氨基,则另外取代基为-CH2CH2OH或-CH(OH)CH3,则可能的结构有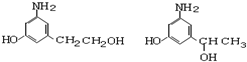 ,
,
故答案为: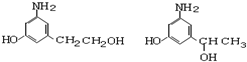 ;
;
(5)香兰素和硝基甲烷发生加成反应生成 ,
, 反应生成A,A和氢气加成生成
反应生成A,A和氢气加成生成 ,对比
,对比 和
和 可知,
可知, 先发生消去反应生成A,A再和氢气发生加成反应生成
先发生消去反应生成A,A再和氢气发生加成反应生成 ,所以A的结构简式为
,所以A的结构简式为 ,
, 和Zn、HCl发生还原反应生成
和Zn、HCl发生还原反应生成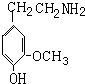 ,
,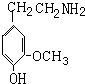 发生水解也是取代反应生成多巴胺,同时还生成甲醇.
发生水解也是取代反应生成多巴胺,同时还生成甲醇.
Ⅰ.反应①属于取代反应,反应②属于消去反应,故答案为:取代反应;消去反应;
Ⅱ.A的结构简式为: ,故答案为:
,故答案为: ;
;
Ⅲ.反应②的化学方程式为: ,反应⑤的化学方程式:
,反应⑤的化学方程式: ,
,
故答案为: ;
; .
.
点评 本题考查有机物的推断与合成、有机物的结构与性质合、有机反应类型、有机反应方程式书写等,是对有机化学基础的综合考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | M的能量一定低于X的,N的能量一定低于Y的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中化学键吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | M和N的总能量一定低于X和Y的总能量 |
| A. | Na和Na+的化学性质相似 | |
| B. | 钠在空气中燃烧生成氧化钠 | |
| C. | 钠可与硫酸铜溶液反应得到铜 | |
| D. | 实验室通常把钠保存在石蜡油或煤油中 |
| A. | 18gH2O所含的电子数目为9N0 | |
| B. | 0.1 mol/L Na2SO4溶液所含Na+数目为0.2N0 | |
| C. | 1 mol钠完全反应时所失去的电子数为N0 | |
| D. | 标准状况下22.4L O2所含的原子数目为N0 |
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点
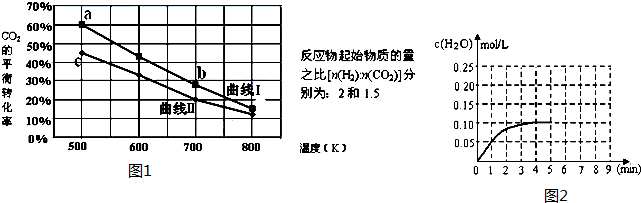
(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
| A. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 |
| A. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| B. | 60gSiO2中含有NA个SiO2分子 | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA | |
| D. | 1molFe与1mol氯气反应转移3NA个电子 |
| A. | 在浓硫酸的作用下,乙醇和乙酸共热的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在光照条件下甲烷与氯气的反应 | |
| D. | 在浓硫酸的作用下,苯在55℃左右与浓硝酸的反应 |