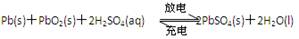题目内容
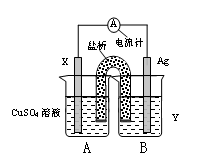
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
(1)A,B两个装置中,属于原电池的是 (填标号)
(2)A池中,铜极为 极,发生 反应,(填“氧化”“还原”)电极反应式为: 。
(3)B池中,左边C是 极,电极反应式为: ;
总反应式为 。
(4)B池中当阴极产生6.4g铜时,阳极放出 g气体。

(1)A,B两个装置中,属于原电池的是 (填标号)
(2)A池中,铜极为 极,发生 反应,(填“氧化”“还原”)电极反应式为: 。
(3)B池中,左边C是 极,电极反应式为: ;
总反应式为 。
(4)B池中当阴极产生6.4g铜时,阳极放出 g气体。
(1)A (2)正;还原;2H++2e-=H2↑(3)阳极;2Cl--2e-=Cl2↑;CuCl2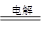 Cu+Cl2↑
Cu+Cl2↑
(4)7.1
 Cu+Cl2↑
Cu+Cl2↑ (4)7.1
(1)装置A中没有外接电源,是原电池,B是电解池。
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,发生还原反应产生氢气。
(3)左侧电极和电源的负极相连,作阳极,溶液中的氯离子放电,产生氯气。阳极阴极是铜离子放电,析出铜,所以总反应式为CuCl2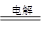 Cu+Cl2↑。
Cu+Cl2↑。
(4)生成6.4g铜转移的电子是6.4g÷64g/mol×2=0.2mol。根据电子的得失守恒可知,阳极产生的氯气是0.2mol÷2=0.1mol,质量是0.1mol×71g/mol=7.1g。
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,发生还原反应产生氢气。
(3)左侧电极和电源的负极相连,作阳极,溶液中的氯离子放电,产生氯气。阳极阴极是铜离子放电,析出铜,所以总反应式为CuCl2
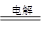 Cu+Cl2↑。
Cu+Cl2↑。(4)生成6.4g铜转移的电子是6.4g÷64g/mol×2=0.2mol。根据电子的得失守恒可知,阳极产生的氯气是0.2mol÷2=0.1mol,质量是0.1mol×71g/mol=7.1g。

练习册系列答案
相关题目