题目内容
15. 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
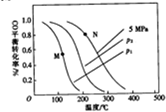
(2)以投料比$\frac{n({H}_{2})}{n(CO)}$=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
| 方法 | 催化剂 | 条件 | 备注 | 特点 | |
| 压力/MPa | 温度/℃ | ||||
| 高压法 | ZnO-Cr2O3 二元催化剂 | 25-30 | 380-400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
| 低压法 | CuO-ZnO-Al2O3 三元催化剂 | 5 | 230-270 | 1966年工业化 | (1)催化剂易中毒,再生容易 (2)副反应少 |
分析 (1)已知:
①C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
②C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
根据盖斯定律①-②得CO(g)+H2O(g)=CO2(g)+H2(g)据此计算;
(2)①分析图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向进行分析反应能量变化;
增大压强,平衡向着气体体积减小的方向移动;
②该反应为放热反应,温度越高,K越小;
③增大氢气的浓度,平衡正向移动;
④由表可知其优点是:1、压强低,对设备要求不高;2、反应温度低,节省能源;3、催化剂再生容易,副反应少.
解答 解:(1)①C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
②C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
根据盖斯定律:由①-②得CO(g)+H2O(g)=CO2(g)+H2(g),△H3=-40.7kJ•mol-1;
故答案为:-40.7;
(2)①由图象可知,一氧化碳转化率随温度升高减小,说明升高温度,平衡逆向移动,正反应为放热反应,故△H<0;
CO(g)+2H2(g)=CH3OH(g),增大压强,平衡正向移动,CO的转化率增大,故P1<P2,
故答案为:<,<;
②由图可以N点的温度高于M点,由于该反应为放热反应,温度越高,K越小,所以M点对应的平衡常数K大于N点对应的平衡常数;
故答案为:>;
③提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],相当于增大氢气的浓度,平衡正向移动,CO的平衡转化率将增大,
故答案为:增大;
④由表可知其优点是:1、压强低,对设备要求不高;2、反应温度低,节省能源;3、催化剂再生容易,副反应少;
故答案为:低压法所需设备要求低,副反应少,催化剂易再生.
点评 本题考查盖斯定律的应用、化学平衡的影响因素、平衡常数的应用等,题目难度中等,侧重于考查学生的分析能力和解决问题的能力.

| A. | X=2Y | B. | 2X=Y | C. | X=Y | D. | 无法确定 |
| A. | 相关微粒浓度关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液所含阴阳离子的总数依次减小 | |
| C. | 三种溶液均加水稀释到1000mL,pH分别变为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数依次减小 |
| A. | 采用无毒无害的原料,生产有利环保、人体健康、安全的产品 | |
| B. | 在无毒、无害的条件下反应,减少废物向环境排放 | |
| C. | 充分利用能源、资源,提高原子利用率、使原料的原子都成为产品 | |
| D. | 充分利用绿色原料进行化工生产,产出绿颜色产品 |
| A. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| B. | 石油分馏可得到石油气、汽油、煤油、柴油等 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 |
