题目内容
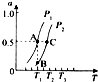
1.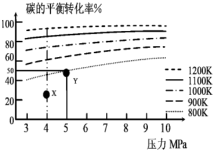 煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )| A. | 上述逆反应为吸热反应 | |
| B. | 在5MPa、800K时,该反应的平衡常数为$\frac{V}{a}$ | |
| C. | 在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | |
| D. | 工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者氢气的转化率高 |
分析 A、温度越高碳的平衡转化率越大,所以平衡正向移动,由此分析热效应;
B、根据碳转化率为50%,结合三行式求平衡时各组分的浓度,然后代入平衡常数表达式计算求解;
C、根据X点反应的移动方向来确定正反应速率和逆反应速率的关系;
D、根据压强对反应速率以及平衡的移动的影响并结合生产实际来回答判断.
解答 解:A、由图观察,温度越高碳的平衡转化率越大,平衡正向移动,正反应为吸热反应,故A错误;
B、在5MPa、800K时,此时碳转化率为50%,
C(s)+2H2(g)?CH4(g)
始量量:a a
转化量:0.25a 0.5a 0.25a
平衡量:0.75a 0.5a 0.25a
K=$\frac{\frac{0.25a}{V}}{(\frac{0.5a}{V})^{2}}$=$\frac{V}{a}$,故B正确;
C、由图观察,X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,故C正确;
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,故D错误.
故选ABC.
点评 本题考查化学平衡有关问题,注意化学平衡状态的判断以及平衡常数的有关计算是解题的关键,难度中等.

练习册系列答案
相关题目
16.请根据短周期元素在元素周期表中的位置,结合所提供的图表回答下列问题:
(1)元素周期表第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,其中A的晶体类型是离子晶体,
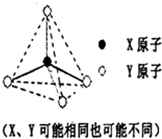
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).

9.下列说法正确的是( )
| A. | 用福尔马林对种子消毒不属于蛋白质变性 | |
| B. | 能用新制的氢氧化铜鉴别果糖与葡萄糖溶液 | |
| C. | 实验证实化合物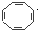 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| D. | 化合物的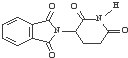 分子式为C13H8O4N2 分子式为C13H8O4N2 |
13.水是生命之源,保护水资源、节约用水是我们义不容辞的责任.下图所表示的做法不能节约用水的是( )
| A. |  浴擦肥皂时,暂时关上喷头 | B. |  洗衣后的水用来拖地 | ||
| C. |  水龙头坏了,立即进行修理 | D. |  用水管不间断地冲洗汽车 |
11.要除去下列物质中所含有的少量杂质,所选用的试剂和方法错误的是( )
| 序号 | 物质 | 杂质 | 试剂 | 方法 |
| A | CH3CH2OH | H2O | CaO | 蒸馏 |
| B | CH3COOC2H5 | CH3COOH | CH3CH2OH、浓H2SO4 | 加热 |
| C | 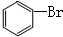 | Br2 | NaOH溶液 | 振荡、静置、分液 |
| D | CH3CH2OH | CH3COOH | NaOH | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
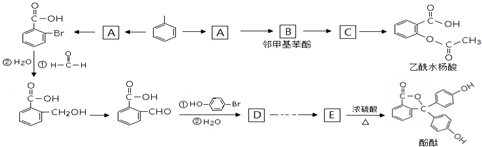
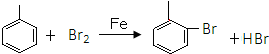 .
.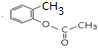 ,E分子中的含氧官能团名称为羧基、羟基;
,E分子中的含氧官能团名称为羧基、羟基;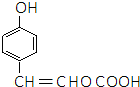 或
或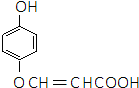 的邻、间、对的任意一种.
的邻、间、对的任意一种. .
.