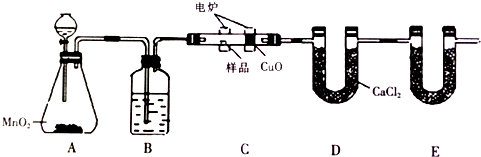
题目内容
5.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ•mol-1,在容器中充入2mol SO2和1mol O2,充分反应,最终放出的热量( )| A. | 等于196.64kJ | B. | 等于98.32kJ | C. | 小于196.64kJ | D. | 大于196.64kJ |
分析 根据热化学方程式得出生成1molSO3时放出的热量,利用极限法计算出2mol SO2和1molO2反应生成SO3的物质的量,计算放出的热量,由于可逆反应的不完全性,所以放出的热量小于按极限法计算放出的热量.
解答 解:根据热化学方程式SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,2mol SO2和1molO2不能完全反应,所以放出的热量小于196.64kJ,
故选C.
点评 本题以反应热的计算为载体,考查可逆反应的不完全性,注意可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物,题目难度不大.

练习册系列答案
相关题目
15.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | |
| B. | x的电负性大于y的电负性 | |
| C. | x的核电荷数大于y的核电荷数 | |
| D. | x的第一电离能小于y 的第一电离能 |
16.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示( )
| A. | v(O2)=0.010 mol•L-1•s-1 | B. | v(NO)=0.008 mol•L-1•s-1 | ||
| C. | v(H2O)=0.006 mol•L-1•s-1 | D. | v(NH3)=0.002 mol•L-1•s-1 |
20.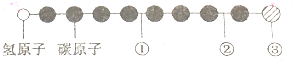 据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )
据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )
 据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )
据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )| A. | ①处的化学键表示碳碳双键 | B. | 此星际分子属于烃类 | ||
| C. | ③处的原子可能是氯原子或氟原子 | D. | ②处的化学键表示碳碳单键 |
10.下列说法正确的是( )
| A. | 物质的量是一个基本单位 | |
| B. | 1mol水分子中含有1mol氢分子和1mol氧原子 | |
| C. | 1molH2O的质量等于NA个H2O质量的总和 | |
| D. | 摩尔就是物质的量 |
17.100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入数滴氯化铜溶液 | B. | 加入适量的6 mol•L-1的盐酸 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
14.水资源非常重要,联合国确定2003年为国际淡水年.下列关于水的说法中,错误的是( )
| A. | 蒸馏法是海水淡化的方法之一 | |
| B. | 淡水的密度小于海水的密度 | |
| C. | 融化的雪水中矿物质含量比深井水中的少 | |
| D. | 天然水经过混凝法净化即可作为生活用水 |
15.将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )
| A. | a g | B. | $\frac{3a}{4}$ g | C. | $\frac{3a}{2}$ g | D. | $\frac{4a}{3}$g |