题目内容
17.100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )| A. | 加入数滴氯化铜溶液 | B. | 加入适量的6 mol•L-1的盐酸 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
分析 增大反应速率但不影响生成氢气总量,因为稀盐酸的量一定,可以通过改变浓度、温度、反应物接触面积都方法实现目的,但加入物质时不能和稀盐酸反应生成盐等物质.
解答 解:A.加入氯化铜溶液,Zn置换出Cu,Zn、Cu和稀盐酸构成原电池,加快反应速率,因为稀盐酸的物质的量不变,所以生成氢气总量不变,故A正确;
B.加入适量稀盐酸,稀盐酸的物质的量增大,导致生成氢气总量增加,故B错误;
C.加入适量蒸馏水,氢离子浓度降低,反应速率降低,故C错误;
D.加入适量氯化钠溶液,氢离子浓度降低,反应速率降低,因为稀盐酸物质的量不变,则生成氢气总量不变,故D错误;
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,温度、浓度、催化剂、反应物接触面积、原电池等都影响化学反应速率,注意题干中限制性条件“增大反应速率、生成氢气总量不变”,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
7.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
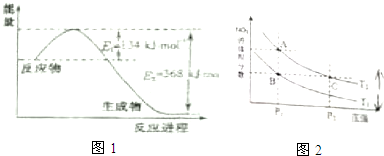
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.已知平衡常数K与温度T的关系如表:
①试判断K1<K2(填写“>”“=”或“<”)
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.采用较高温度(400℃~500℃) B.将生成的氨液化并及时从体系中分离出来
C.用铁触媒加快化学反应速率 D.采用较高压强(20MPa~50MPa)
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是CD
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法.

(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.已知平衡常数K与温度T的关系如表:
| T/℃ | 400 | 300 |
| 平衡常致K | K1 | K2 |
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.采用较高温度(400℃~500℃) B.将生成的氨液化并及时从体系中分离出来
C.用铁触媒加快化学反应速率 D.采用较高压强(20MPa~50MPa)
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是CD
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法.
8.在一密闭容器中,反应 aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,则( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
5.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ•mol-1,在容器中充入2mol SO2和1mol O2,充分反应,最终放出的热量( )
| A. | 等于196.64kJ | B. | 等于98.32kJ | C. | 小于196.64kJ | D. | 大于196.64kJ |
2.某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |
9.下列能用勒沙特列原理解释的是( )
| A. | 在硫酸亚铁溶液中,加入铁粉以防止氧化 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
6.某溶液中含Na+、Ba2+、Ag+三种阳离子,该溶液中的阴离子可能是( )
| A. | NO3- | B. | SO42- | C. | CO32- | D. | Cl- |
7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |