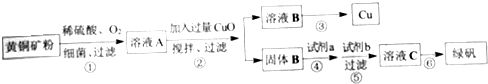
题目内容
13.如图装置是用燃烧法确定有机物组成的常用装置,其原理是在电炉加热条件下用纯氧氧化管内样品,根据产物的质量确定有机物的组成.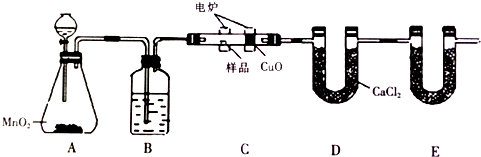
回答下列问题:
(1)C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O
(2)写出E装置中所盛放物质的名称碱石灰或氢氧化钠,它的作用是吸收CO2.
(3)准确称取1.20g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,该有机物的相对分子质量为180,则其分子式为C6H12O6.
(4)B中盛放的试剂是浓硫酸,若舍去B装置,则测得有机物中氧元素的含量偏低(填“偏高”、“偏低”或“无影响”).
分析 实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来制取反应所需的氧气、B用来吸收水、C是在电炉加热时用纯氧气氧化管内样品、D用来吸收产生的水、E是防止空气中的水进入D;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;由此进行解答.
解答 解:(1)CuO的作用是使有机物充分氧化生成CO2和H2O,故答案为:使有机物充分氧化生成CO2和H2O;
(2)E装置中所盛放物质最好选用碱石灰或氢氧化钠,因为氢氧化钠可以完全吸收反应生成的二氧化碳,故盛放物质为碱石灰或氢氧化钠.它的作用是吸收CO2气体,
故答案为:碱石灰或氢氧化钠;吸收CO2;
(3)E管质量增加1.76克说明生成了1.76克二氧化碳,可得碳元素的质量:1.76g×$\frac{12}{44}$×100%=0.48g,D管质量增加0.72克说明生成了0.72克水,可得氢元素的质量0.72g×$\frac{2}{18}$×100%=0.08g,从而可推出含氧元素的质量为:1.2-0.48-0.08=0.64g,设最简式为CXHYOZ,则:12X:Y:16Z=0.48::0.08:0.64,故X:Y:Z=1:2:1
故该有机物的最简式为CH2O,而该有机物的相对分子质量为180,所以分子式为C6H12O6,故答案为:C6H12O6;
(4)B中盛放的是液体干燥剂浓硫酸,若舍去B装置,则测得有机物中氢元素的含量增大,氧元素的含量减小,故答案为:浓硫酸;偏低.
点评 本题是一道较综合的实验题,主要考查学生运用所学化学知识综合分析和解决实际问题的能力;增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

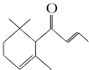 一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H18O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗18 mol O2 | |
| D. | 与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验生成的离子 |
| A. | 稳定性:HF>HCl>HBr>HI | |
| B. | 非金属最高氧化物的水化物酸性:HClO4>H2SO4>H2PO4>H2SiO3 | |
| C. | 金属最高价氧化物的水化物碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 挥发性:HCl>HNO3>H2SO4 |
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
| A. | 按系统命名法,化合物 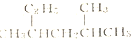 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. | 等质量的甲烷、乙烯、乙炔分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 苯酚、水杨酸(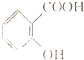 )和苯甲酸都是同系物 )和苯甲酸都是同系物 | |
| D. | 2,2-二甲基-1-丁醇与2-甲基-2-丁醇互为同分异构体 |
| A. | 等于196.64kJ | B. | 等于98.32kJ | C. | 小于196.64kJ | D. | 大于196.64kJ |
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |