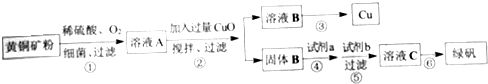
题目内容
15.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )| A. | x的原子半径大于y的原子半径 | |
| B. | x的电负性大于y的电负性 | |
| C. | x的核电荷数大于y的核电荷数 | |
| D. | x的第一电离能小于y 的第一电离能 |
分析 x元素的印离子和y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则y元素处于x元素的下一周期,x为非金属元素,最外层电子数较多,y为金属元素,最外层电子数相对较少.
解答 解:x元素的印离子和Y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则y元素处于X元素的下一周期,x为非金属元素,最外层电子数较多,y为金属元素,最外层电子数相对较少,
A.y元素处于x元素的下一周期,x为非金属元素,原子半径小于同周期与y处于同族的元素,故原子半径y>x,故A错误;
B.x为非金属元素,y为金属元素,故x的电负性大于y的电负性,故B正确;
C.y元素处于x元素的下一周期,x的核电荷数小于y的核电荷数,故C错误;
D.x为非金属元素,y为金属元素,故x的第一电离能大于y的第一电离能,故D错误;
故选B.
点评 本题考查结构与位置的关系、半径与电负性、第一电离能比较等,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.

练习册系列答案
相关题目
5.某烃分子中有两个双键,它的分子式可能是( )
| A. | C4H6 | B. | C7H8 | C. | C5H10 | D. | C10H22 |
6.下列叙述不正确的是( )
| A. | H2S、H2O、HF的稳定性依次增强 | |
| B. | RbOH、KOH、Mg(OH)2的碱性依次减弱 | |
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | |
| D. | H2SiO3、H2CO3、H2SO4 酸性依次增强 |
10.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| B. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| C. | 58.5 g的NaCl固体中含有NA个氯化钠分子 | |
| D. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA |
20.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢可形成原子个数比为1:4的化合物 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成化合物XZ2 |
7.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
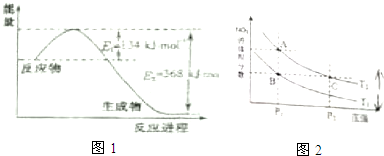
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.已知平衡常数K与温度T的关系如表:
①试判断K1<K2(填写“>”“=”或“<”)
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.采用较高温度(400℃~500℃) B.将生成的氨液化并及时从体系中分离出来
C.用铁触媒加快化学反应速率 D.采用较高压强(20MPa~50MPa)
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是CD
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法.

(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.已知平衡常数K与温度T的关系如表:
| T/℃ | 400 | 300 |
| 平衡常致K | K1 | K2 |
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.采用较高温度(400℃~500℃) B.将生成的氨液化并及时从体系中分离出来
C.用铁触媒加快化学反应速率 D.采用较高压强(20MPa~50MPa)
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是CD
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法.
4.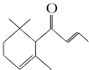 一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )
 一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H18O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗18 mol O2 | |
| D. | 与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验生成的离子 |
5.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ•mol-1,在容器中充入2mol SO2和1mol O2,充分反应,最终放出的热量( )
| A. | 等于196.64kJ | B. | 等于98.32kJ | C. | 小于196.64kJ | D. | 大于196.64kJ |