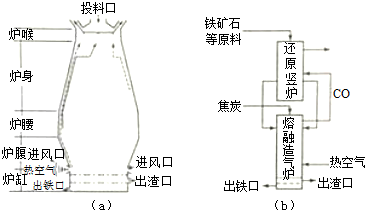
题目内容
13.下列叙述错误的是( )| A. | 向蛋白质溶液中加入CuSO4溶液,蛋白质发生变性 | |
| B. | 一定条件下,乙醇能被氧化成一种刺激性气味的液体 | |
| C. | 用Cl2和NaOH溶液为原料制备次氯酸钠 | |
| D. | 海水提溴和生产玻璃过程中均涉及氧化还原反应 |
分析 A.蛋白质遇重金属盐发生变性;
B.乙醇能被氧化成乙醛;
C.氯气跟氢氧化钠溶液反应:Cl2+2NaOH=NaClO+NaCl+H2O;
D.制造普通玻璃的反应类型主要是复分解反应.
解答 解:A.硫酸铜是重金属盐,蛋白质遇重金属盐发生变性,故A正确;
B.乙醇能被氧化成乙醛,乙醛有刺激性气味,故B正确;
C.氯气跟氢氧化钠溶液反应:Cl2+2NaOH=NaClO+NaCl+H2O,可制得次氯酸钠,故C正确;
D.制造普通玻璃的反应类型主要是复分解反应,不涉及氧化还原反应,故D错误.
故选D.
点评 本题考查氧化还原反应以及物质性质的考查,题目难度不大,本题注意常见工业生产原理,注重基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列有关说法正确的是( )
| A. | 配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克 | |
| B. | 可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 | |
| C. | 加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ | |
| D. | 取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+ |
1.化学用语是学习化学的重要工具.以下化学用语或表述正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 碳正离子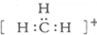 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| C. | 水合氢离子的结构式为  | |
| D. | NaHCO3水解反应的离子方程式:HCO3-+H2O?H3O++CO32- |
5.下列有机物其一氯代物的结构可能只有一种的是( )
| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
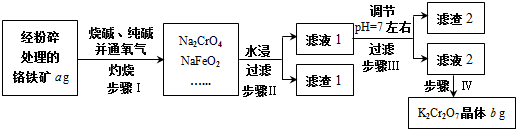
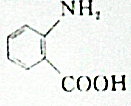 的同分异构体的结构简式:
的同分异构体的结构简式: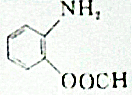 .
.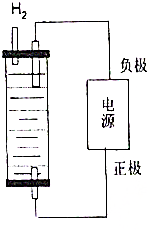 制取漂白粉的氯气通过电解饱和食盐水得到.
制取漂白粉的氯气通过电解饱和食盐水得到.