题目内容
20.室温时,下列溶液混合后,pH大于7的是( )| A. | 0.1mol/L的盐酸和pH=13的氢氧化钡溶液等体积混合 | |
| B. | 0.1mol/L的NaHCO3溶液和pH=1的盐酸等体积混合 | |
| C. | pH=3的硫酸和pH=11的氨水等体积混合 | |
| D. | pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合 |
分析 常温下,酸和碱溶液等体积混合后溶液的pH大于7,说明溶液呈碱性,
A.pH=13的氢氧化钡溶液中氢氧根离子浓度为0.1mol/L,两溶液混合后恰好生成氯化钡和水,溶液呈中性;
B.pH=1的盐酸中氢离子浓度为0.1mol/L,两溶液恰好反应生成氯化钠,溶液为中性;
C.pH=3的硫酸中氢离子浓度为0.001mol/L,pH=11的氨水中氢氧根离子浓度为0.001mol/L,两溶液等体积混合后氨水过量,溶液呈碱性;
D.醋酸为弱酸,混合液中醋酸过量,溶液显示酸性.
解答 解:A.室温时pH=13的氢氧化钡溶液中氢氧根离子浓度为0.1mol/L,与0.1mol/L的盐酸等体积混合恰好生成氯化钡和水,溶液显示中性,溶液的pH=7,故A错误;
B.室温时pH=1的盐酸中氢离子浓度为0.1mol/L,两溶液等体积混合恰好生成氯化钠,溶液呈中性,溶液的pH=7,故B错误;
C.pH=3的硫酸中氢离子浓度为0.001mol/L,pH=11的氨水的浓度大于0.001mol/L,两溶液等体积混合后氨水过量,溶液显示碱性,溶液的pH>7,故C正确;
D.pH=1的醋酸的浓度大于0.1mol/L,混合液中醋酸过量,溶液呈酸性,溶液的pH<7,故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
10.根据热化学方程式:S(g)+O2(g)?SO2(g)△H=-QkJ•mol-1(Q>0),下列分析正确的是( )
| A. | 1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 | |
| B. | 1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 | |
| C. | S(s)+O2(g)?SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
11.四氯化碳按官能团分类应该属于( )
| A. | 烷烃 | B. | 烯烃 | C. | 卤代烃 | D. | 炔烃 |
15.下列电离方程式书写正确的是( )
| A. | CH3COOH═H++CH3COO- | B. | K2SO4═2K++SO42- | ||
| C. | H2CO3?2H++CO32- | D. | Na2CO3?2Na++CO32- |
5.下列叙述正确的是( )
| A. | 在同温同压下,甲容器中的氧气(O2)和乙容器中的氨气(NH3)所含的原子个数相同,则甲、乙两容器中气体的体积之比为1:2 | |
| B. | 任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等 | |
| C. | 在标准状况时,20ml NH3与60ml N2所含的原子个数比为1:3 | |
| D. | 同温同压下,1L一氧化碳气体一定比1L氧气的质量小 |
10.室温下,向a mol/L氨水中逐滴加入等浓度的盐酸,至完全中和,下列描述不正确的是( )
| A. | pH逐渐减小 | B. | n(NH4+)增大 | ||
| C. | 恰好中和时水溶液显中性 | D. | Kw不变 |
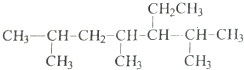 的系统命名是2,4,6-三甲基-3-乙基庚烷.
的系统命名是2,4,6-三甲基-3-乙基庚烷.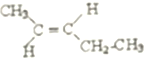 .
.