题目内容
9.pH相同的盐酸(甲)和醋酸(乙),用“>”、“=”或“<”填写:①溶液的物质的量浓度:甲<乙.
②体积相同的两种溶液分别与足量的锌反应,反应刚开始时的速率:甲=乙;整个反应过程的平均速率:甲<乙;生成氢气的量:甲<乙.
③同体积的两种溶液稀释相同倍数后溶液的pH:甲>乙.
分析 盐酸是强酸,能够完全电离,醋酸是弱酸,不能够完全电离,存在电离平衡,pH相同的盐酸和醋酸,氢离子浓度相同,醋酸浓度大于盐酸,在醋酸溶液中随氢离子的减少,醋酸的电离平衡正向移动,据此分析.
解答 解:①盐酸是强酸,能够完全电离,醋酸是弱酸,不能够完全电离,pH相同的盐酸和醋酸,醋酸浓度大于盐酸,故答案为:<;
②pH相同的盐酸和醋酸,氢离子浓度相同,两种溶液分别与足量的锌反应,反应刚开始时的速率相同,醋酸浓度大于盐酸;在醋酸溶液中随氢离子的减少,醋酸的电离平衡正向移动,醋酸中氢离子浓度大于盐酸,所以整个反应过程的平均速率醋酸快;pH相同的盐酸和醋酸,醋酸浓度大于盐酸,生成氢气的量醋酸多,
故答案为:=;<;<;
③盐酸是强酸,能够完全电离,醋酸是弱酸,不能够完全电离,存在电离平衡,在醋酸中加水稀释,醋酸的电离平衡正向移动,氢离子物质的量增大,pH减小比盐酸慢,同体积的两种溶液稀释相同倍数后盐酸溶液的pH大,故答案为:>.
点评 本题考查了强弱电解质的相关知识,注意弱电解质在水溶液中不能完全电离,存在电离平衡,题目难度不大.

练习册系列答案
相关题目
19.W、X、Y、Z是短周期元素,它们的核电荷数依次增大.下表列出它们的性质和结构:
(1)元素符号:XO,ZNa.
(2)Y元素原子的核外最外层电子排布式为3s1.
(3)W和X形成的化合物的电子式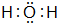 ,该化合物为极性分子(填“极性”或“非极性”).Z和X形成的化合物构成的晶体属于原子晶体.
,该化合物为极性分子(填“极性”或“非极性”).Z和X形成的化合物构成的晶体属于原子晶体.
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外S能级上的电子总数与P能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外P能级上的电子总数比S能级上的电子总数多2 |
(2)Y元素原子的核外最外层电子排布式为3s1.
(3)W和X形成的化合物的电子式
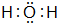 ,该化合物为极性分子(填“极性”或“非极性”).Z和X形成的化合物构成的晶体属于原子晶体.
,该化合物为极性分子(填“极性”或“非极性”).Z和X形成的化合物构成的晶体属于原子晶体.
20.室温时,下列溶液混合后,pH大于7的是( )
| A. | 0.1mol/L的盐酸和pH=13的氢氧化钡溶液等体积混合 | |
| B. | 0.1mol/L的NaHCO3溶液和pH=1的盐酸等体积混合 | |
| C. | pH=3的硫酸和pH=11的氨水等体积混合 | |
| D. | pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合 |
17.下列有关反应:4NH3 (g)+5O2 (g)═4NO(g)+6H2O(g)△H (298K)=-905kJ•mol-1 的描述不正确的是( )
| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 该反应中每4 mol NH3(g)被氧化,放出905 kJ热量 |
4.下列说法正确的是( )
| A. | 液态HCl固体NaCl均不导电,所以HCl、NaCl 均是非电解质 | |
| B. | NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 | |
| C. | 铜 石墨均导电,所以它们均是电解质 | |
| D. | 蔗糖、酒精在水溶液和熔融状态下均不导电,所以它们均是非电解质 |
14.下列各溶液中,Na+的物质的量浓度最大的是( )
| A. | 4L 0.5mol•L-1的NaCl溶液 | B. | 1L 0.3mol•L-1的Na2SO4溶液 | ||
| C. | 0.8L 0.4mol•L-1的NaOH的溶液 | D. | 2L 0.15mol•L-1的Na3PO4的溶液 |
18.下列各关于鉴别NaCl溶液和淀粉溶胶的操作中,说法正确的是( )
| A. | 只能用丁达尔现象 | B. | 只能用AgNO3溶液 | ||
| C. | 只能用碘水 | D. | 以上三种方法都可以 |