题目内容
6.已知2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).是工业制H2SO4的一个重要的反应,控制此反应条件,使之向有利于生成SO3的反应方向进行,下列有关叙述错误的是( )| A. | 使用催化剂(V2O5)可提高该反应的反应速率 | |
| B. | 定期抽走SO3,有利于提高SO3的产率 | |
| C. | 增大O2的浓度,有利于提高SO2的转化率 | |
| D. | 增大SO2的浓度,有利于提高SO2的转化率 |
分析 A、使用催化剂(V2O5)可提高反应速率;
B、减小产物的浓度,可以促使平衡正向移动;
C、增大O2的浓度,可以促使平衡正向移动;
D、增大SO2的浓度,可以促使平衡正向移动.
解答 解:A、使用催化剂(V2O5)可提高反应速率,故A正确;
B、减小产物的浓度,如抽走SO3,可以促使平衡正向移动,有利于提高SO3的产率,故B正确;
C、增大O2的浓度,可以促使平衡正向移动,有利于提高SO2的转化率,故C正确;
D、增大SO2的浓度,可以促使平衡正向移动,但是SO2的转化率会降低,故D错误.
故选D.
点评 本题考查学生催化剂、浓度对化学平衡移动的影响以及转化率的变化判断知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
14.科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2$?_{释氢}^{储氢}$HCOONa+H2O.下列有关说法正确的是( )
| A. | 储氢、释氢过程均无能量变化 | |
| B. | NaHCO3只含离子键 | |
| C. | 储氢过程中,NaHCO3被还原 | |
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
1.下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
| A. | 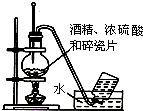 实验室用乙醇制取乙烯 | B. |  实验室制取乙酸乙酯 | ||
| C. | 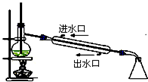 石油分馏 | D. | 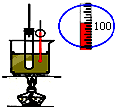 实验室制取硝基苯 |
18.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子总数为0.2 NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 乙二醇与钠的在反应中,每生成1molH2消耗乙二醇1mol | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4 NA |
15.下列说法正确的是( )
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
16.下列说法不正确的是( )
| A. | 化学反应速率通常用单位时间内反应物或生成物的物质的量浓度变化来表示 | |
| B. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 若某化学反应的反应速率为0.5mol/(L•s),就是指在1s内反应物和生成物的浓度变化都为0.5mol/L |
 .
.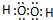 ,化合物XYZ的结构式
,化合物XYZ的结构式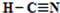 .
.
 .
.