题目内容
【题目】类比![]() 的定义,对于稀溶液可以定义
的定义,对于稀溶液可以定义![]() ,
,![]() ,常温下,
,常温下,![]() 溶液在不同
溶液在不同![]() 值下,测得
值下,测得![]() 、
、![]() 、
、![]() 的变化如图所示,下列说法错误的是( )
的变化如图所示,下列说法错误的是( )
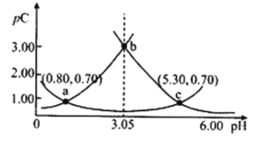
A.随着![]() 的增大,左侧
的增大,左侧![]() 增大的曲线是
增大的曲线是![]() 的物质的量浓度的负对数
的物质的量浓度的负对数
B.![]() 的
的![]() 溶液中,
溶液中,![]()
C.![]() 时,
时,![]()
D.![]() 的电离平衡常数
的电离平衡常数![]()
【答案】B
【解析】
![]() ,pH增加促进电离平衡正向移动,则pH增加,
,pH增加促进电离平衡正向移动,则pH增加,![]() 增多,对应的负对数减小,图像呈下坡趋势,所以由图可知:下方曲线是
增多,对应的负对数减小,图像呈下坡趋势,所以由图可知:下方曲线是![]() 的物质的量浓度的负对数,左侧曲线是
的物质的量浓度的负对数,左侧曲线是![]() 的物质的量浓度的负对数,右侧曲线是
的物质的量浓度的负对数,右侧曲线是![]() 的物质的量浓度的负对数。
的物质的量浓度的负对数。
A.左侧![]() 增大的曲线是
增大的曲线是![]() 的物质的量浓度的负对数,符合题意,故A正确;
的物质的量浓度的负对数,符合题意,故A正确;
B.![]() 的
的![]() 溶液中,根据元素守恒,
溶液中,根据元素守恒,![]() ,则
,则![]() ,故B错误;
,故B错误;
C.根据图像可知,![]() 时,
时,![]() 最小,故C错误;
最小,故C错误;
D.由![]() 可知,
可知, ,交点c对应
,交点c对应![]() ,
,![]() ,故D正确;
,故D正确;
答案选B。

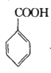
【题目】苯甲酰氯(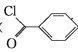 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 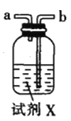 乙.
乙. 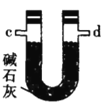 丙.
丙. 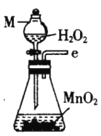 丁.
丁.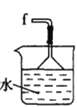 戊.
戊. 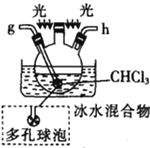
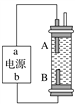
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
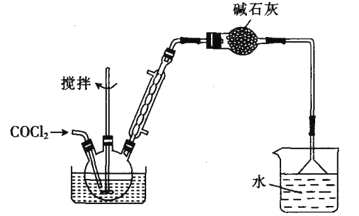
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)![]() 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)![]() SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________。
(2)关于CO还原SO2的反应,下列说法正确的是______。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
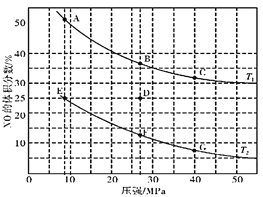
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。
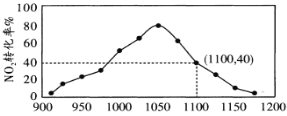
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
【题目】肉桂酸(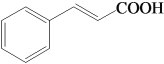 )主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
)主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为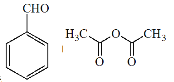
![]()
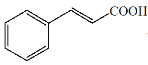 +CH3COOH
+CH3COOH
主要试剂及其物理性质:
名称 | 相对分 子质量 | 性状 | 密度/ (g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解度/(g/100 mL溶剂) | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色 液体 | 1.044 | -26 | 178~179 | 微溶 | 溶 | 溶 |
乙酸酐 | 102 | 无色 液体 | 1.082 | -73 | 138~140 | 反应 | 溶 | 难溶 |
肉桂酸 | 148 | 白色 粉末 | 1.248 | 133~134 | 300 | 微溶 | 溶 | 溶 |
试剂用量:
试剂名称 | 苯甲醛 | 乙酸酐 | 无水碳酸钾 | 10%氢氧化钠 | 浓盐酸 | 活性炭 |
试剂用量 | 3.0 mL | 5.5 mL | 4~5 g | 40 mL | 25 mL | 1.0 g |
实验仪器如下:
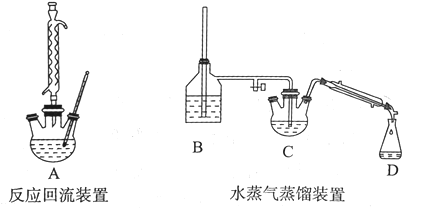
请回答下列问题:
(1)实验准备阶段:在组装实验仪器前要确保反应回流装置彻底干燥,其原因是:_______。
(2)将3.0 mL苯甲醛、5.5 mL乙酸酐和4.00 g无水碳酸钾依次加人250 mL三颈烧瓶中摇匀,烧瓶底部有白色颗粒状固体生成,上部液体无色透明,反应剧烈,有白烟冒出。搭建好回流装置后,开始加热回流。加热回流时控制反应呈微沸状态,加热温度不能太高的原因:_____。
(3)实验结束后,向三颈烧瓶中加人40 mL 10%的氢氧化钠溶液和20 mL的水,可观察到母液体系分为油相和水相。将装置改为水蒸气蒸馏装置,开始加热蒸馏,使油相中的苯甲醛随水蒸气离开母液,开始收集。加人NaOH的作用是:__________。B装置中的长玻璃导管的作用是:_______。水蒸气蒸馏装置中需要加热的仪器有____(填装置序号)。
(4)对蒸气发生器进行加热,待蒸气稳定后再通人烧瓶中的液面下,开始蒸气蒸馏,待检测馏出物中无油滴后停止蒸馏。加人1.0 g活性炭脱色,热过滤。活性炭脱色的原理是______。
(5)加入25 mL的浓盐酸,冰水浴,烧杯中有白色颗粒出现。抽滤(用冰水洗涤),烘箱干燥,称量。称重得m=0.35 g。则该反应的产率约为_____(结果精确至0.1% )。