题目内容
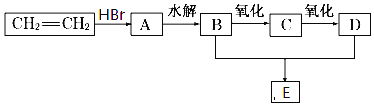
【题目】苯甲酰氯(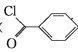 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 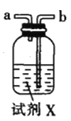 乙.
乙. 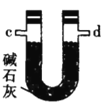 丙.
丙. 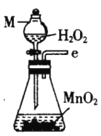 丁.
丁.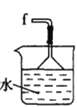 戊.
戊. 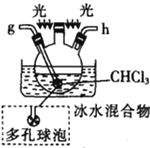
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
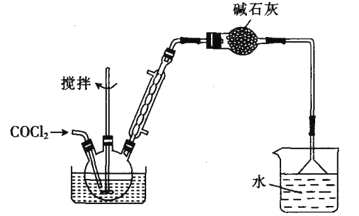
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
【答案】分液漏斗 e g h b a f 浓硫酸 干燥气体,防止水蒸气进入装置戊中 防止三氯甲烷挥发,使碳酰氯液化 增大反应物之间的接触面积,加快反应速率 COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O 79.3%
【解析】
(1)看图得出仪器M的名称。
(2)根据已知,碳酰氯与水反应,因此要干燥氧气,且后面产物中要隔绝水蒸气,再得出顺序。
(3)根据已知信息,碳酰氯不能见水,因此整个环境要干燥,故得到答案。
(4)根据(2)中得到装置乙中碱石灰的作用是干燥气体。
(5)根据碳酰氯(COCl2)沸点低,三氯甲烷易挥发,得出结论,多孔球泡的作用是增大反应物之间的接触面积,加快反应速率。
Ⅱ(6)碳酰氯也可以用浓氨水吸收,生成尿素和氯化铵,再写出反应方程式,先根据方程式计算实际消耗了苯甲酸的质量,再计算转化率。
(1)仪器M的名称是分液漏斗,故答案为:分液漏斗。
(2)根据已知,碳酰氯与水反应,因此要干燥氧气,且后面产物中要隔绝水蒸气,因此X要用浓硫酸干燥,按气流由左至右的顺序为e→c→d→g→h→b→a→f,故答案为:e;g;h;b;a;f。
(3)根据上题得出试剂X是浓硫酸,故答案为:浓硫酸。
(4)根据(2)中得到装置乙中碱石灰的作用是干燥气体,防止水蒸气进入装置戊中,故答案为:干燥气体,防止水蒸气进入装置戊中。
(5) 碳酰氯(COCl2)沸点低,三氯甲烷易挥发,因此装置戊中冰水混合物的作用是防止三氯甲烷挥发,使碳酰氯液化;多孔球泡的作用是增大反应物之间的接触面积,加快反应速率,故答案为:防止三氯甲烷挥发,使碳酰氯液化;增大反应物之间的接触面积,加快反应速率。
Ⅱ(6)碳酰氯也可以用浓氨水吸收,生成尿素和氯化铵,该反应的化学方程式:COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O,
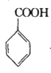 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
121g 140.5g
xg 562g
121g:xg = 140.5g:562g
解得x=484g
![]() ,故答案为:COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O,79.3%。
,故答案为:COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O,79.3%。

 名校课堂系列答案
名校课堂系列答案【题目】硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
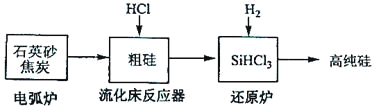
发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反应器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______;碳化硅又称_______,其晶体结构与_______相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为_______。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______。