题目内容
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
N2(g)+2O2(g)![]() 2NO2(g) △H=+68 kJ/mol
2NO2(g) △H=+68 kJ/mol
则 2NO(g)+O2(g)![]() 2NO2(g) △H=__________ kJ/mol
2NO2(g) △H=__________ kJ/mol
(2)对于反应2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
第一步:2NO(g)![]() N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)![]() 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是__________
A. 整个反应的速率由第一步反应速率决定
B. 同一温度下,平衡时第一步反应的![]() 越大,反应正向程度越大
越大,反应正向程度越大
C. 第二步反应速率慢,因而平衡转化率也低
D. 第二步反应的活化能比第一步反应的活化能高
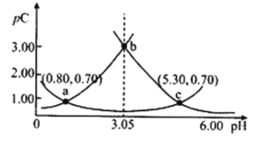
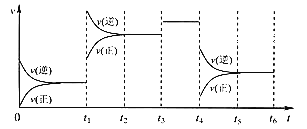
(3)在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H<0,图为平衡时NO的体积分数与温度、压强的关系:
2CO2(g)+N2(g) △H<0,图为平衡时NO的体积分数与温度、压强的关系:
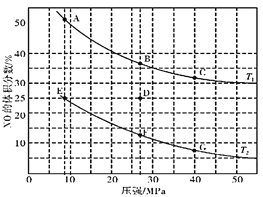
①温度:T1__________T2(填“>”、“<”或“=”)。
②若在D点对反应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的__________点(填字母)。
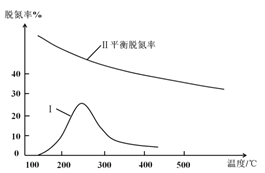
③某研究小组探究该反应中催化剂对脱氮率(即NO转化率)的影响。将相同量的NO和CO 以一定的流速分别通过催化剂a和b,相同时间内测定尾气,a结果如图中曲线I所示。已知:催化效率 b>a;b的活性温度约450℃。在图中画出b所对应的曲线(从300℃开始画) _______。
(4)在汽车的排气管上加装催化转化装置可减少NOx的排放。研究表明,NOx的脱除率除与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+X(A、B 均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:I . NO(g)+□→NO(a)
II . 2NO(a)→2N(a)+O2(g) III. 2N(a)→N2(g)+2□
IV. 2NO(a)→N2(g)+2O(a) V. 2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原 B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是________。
【答案】-112 BD > A  还原后催化剂中金属原子的个数不变,低价态金属离子越多,氧缺位增多,反应速率加快
还原后催化剂中金属原子的个数不变,低价态金属离子越多,氧缺位增多,反应速率加快
【解析】
(1)根据盖斯定律,将已知的两个热化学方程式相减,整理,可得待求反应的热化学方程式;
(2)A. 整个反应的速率由慢反应决定;
B. 根据①同一温度下,平衡时第一步反应的k1正/k1逆越大,化学平衡常数越大;
C. 反应速率低与转化率无因果关系;
D. 相同温度下,第一步反应快速达到平衡,第二步是慢反应,反应越快,说明反应的活化能越低;反应越慢,说明反应的活化能越高;
(3)①根据压强不变时,升高反应温度,化学平衡逆向移动,利用温度对NO的体积分数的影响确定T1与T2大小关系;
②对容器升高温度的同时扩大体积使体系的压强减小,则平衡逆向移动,NO体积分数增大;
③根据在一定温度范围内,升高温度,催化剂活性较大,超过其温度范围,催化剂活性降低,催化剂不能使平衡发生移动,不能改变物质的平衡转化率,催化效率高,反应速率快,先达到化学平衡状态;
(3)还原后催化剂中金属原子的个数不变,低价态金属离子越多,氧缺位增多,反应速率加快;根据盖斯定律分析可得。
(1)已知①N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g)![]() 2NO2(g) △H=+68 kJ/mol
2NO2(g) △H=+68 kJ/mol
盖斯定律计算②-①,整理可得2NO(g) +O2(g)![]() 2NO2(g) △H=-112 kJ/mol;
2NO2(g) △H=-112 kJ/mol;
(2) A.整个反应的速率由慢反应决定,A错误;
B. 根据①同一温度下,平衡时第一步反应的![]() 越大,化学平衡常数越大,则反应正向程度越大,B正确;
越大,化学平衡常数越大,则反应正向程度越大,B正确;
C. 反应速率低与转化率大小无关,因此不能根据反应速率慢判断反应达到平衡时物质的转化率小,C错误;
D. 相同温度下,第一步反应快速达到平衡,第二步是慢反应,说明第二步反应的活化能比第一步反应的活化能高,D正确;
故合理选项是BD;
(3)①该反应的正反应是气体体积减小的放热反应,在压强不变时,升高温度,化学平衡向吸热的逆反应方向移动,使NO的体积分数增大,根据图象可知:在温度为T1时体积分数大,可确定温度:T1>T2;
②该反应的正反应为放热反应,在相同压强时,温度升高,平衡逆向移动,NO体积分数增大,根据图象可知反应温度:B>D>F。在D点对反应容器升温的同时扩大体积,使体系的压强减小,则化学平衡逆向移动,最终导致NO的体积分数增大,所以重新达到平衡时,可能D点变为图中的A点;
③在一定温度范围内温度升高,催化剂活性增大,但达到平衡时NO脱除率降低,且催化剂b的催化效率 b>a,b的活性温度约450℃。在相同温度时,b比a先使NO达到最大脱氮率,所以催化剂b的曲线表示为 ;
;
(3)第一阶段用氢气还原B4+得到低价态的金属离子增多,还原后催化剂中金属原子的个数不变,价态降低,低价态的金属离子越多,氧缺位增多,反应速率加快,故第二阶段反应的速率越快。

 教学练新同步练习系列答案
教学练新同步练习系列答案