题目内容
【题目】某同学设计了一种电解法制取Fe(OH)2的实验装置(如图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是( )
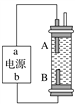
A. 电源中a为负极,b为正极
B. 电解池中的电解液不可以是NaCl溶液
C. B电极发生的反应:2H++2e-===H2↑
D. A、B两端都必须使用铁作电极
【答案】C
【解析】分析:A.B端析出氢气可驱赶原溶液中溶解的少量氧气;
B.阳极上铁失电子得到亚铁离子,阴极上氢离子放电,据此判断电解质溶液;
C.阴极上得电子生成氢气;
D.阳极应该用铁电极,阴极用惰性电极亦可。
详解:A、因为生成的氢气将装置中原有氧气带出,且氢气的密度小于水,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,所以“a”为正极,“b”为负极,A错误;
B、因为阳极是铁,活泼电极作阳极时,阳极材料铁失电子生成亚铁离子,阴极上氢离子放电,生成氢气,所以能生成氢氧化亚铁白色沉淀,则电解液选用NaCl溶液不影响实验,B错误;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,阴极上氢离子得电子生成氢气,同时破坏水的电离平衡,产生氢氧根离子,氢气能防止氢氧化亚铁被氧化而导致实验失败,所以电极反应式为:2H++2e-=H2↑,C正确;
D、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,D错误;答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。