题目内容
12.完成下列反应的化学方程式(1)氢氧化铁胶体的制备FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)工业上冶炼金属铝2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(3)除去碳酸氢钠溶液中的碳酸钠Na2CO3+CO2+H2O=2NaHCO3.
分析 (1)实验室用氯化铁溶液和沸水制取氢氧化铁胶体,氯化铁水解生成氢氧化铁和HCl;
(2)工业上采用电解熔融氧化铝的方法冶炼铝;
(3)碳酸钠和二氧化碳、水反应生成碳酸氢钠,所以除去碳酸氢钠溶液中的碳酸钠采用通入过量二氧化碳的方法.
解答 解:(1)实验室用氯化铁溶液和沸水制取氢氧化铁胶体,氯化铁水解生成氢氧化铁和HCl,反应方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)工业上采用电解熔融氧化铝的方法冶炼铝,反应方程式为2Al2O3 $\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3 $\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(3)碳酸钠和二氧化碳、水反应生成碳酸氢钠,所以除去碳酸氢钠溶液中的碳酸钠采用通入过量二氧化碳的方法,反应方程式为Na2CO3+CO2+H2O=2NaHCO3,故答案为:Na2CO3+CO2+H2O=2NaHCO3.
点评 本题以除杂、金属冶炼、物质制备为载体考查化学方程式的书写,根据物质的性质结合反应条件书写方程式,注意除杂剂的选取方法,注意:工业上采用电解熔融氧化铝而不是氯化铝的方法冶炼铝,题目难度不大.

练习册系列答案
相关题目
2.用一种试剂和必要的实验操作就能鉴别NaHCO3、NaCl、KCl、K2SO4四种物质,此试剂与实验操作是( )
| A. | 盐酸、焰色反应 | B. | Ba(OH)2溶液、焰色反应 | ||
| C. | 盐酸、加热 | D. | BaCl2溶液、焰色反应 |
7.下列有关能源和能量转换的叙述正确的是( )
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 普通锌锰干电池不含环境污染物,用完后可以随意扔掉,使用方便 | |
| D. | 燃料电池是利用燃料燃烧,将化学能转化为热能,然后再转化为电能的化学电源 |
4.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,下列说法正确的是( )
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:4 | ||
| C. | 分子中可能含有氧原子 | D. | 此有机物的最简式为CH4 |
1.已知25℃时:
在无机化合物的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶.
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶.
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶.请回答下列问题:
(1)下列与方案③相关的叙述中,正确的是ACD(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
(2)方案③中,当Fe3+全沉淀时,溶液中c(Cu2+)的范围为≤2.2mol/L.
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-15 | 4.0×10-38 |
| 完全沉淀时的pH | ≥5.0 | ≥5.5 | ≥4.0 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶.
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶.
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶.请回答下列问题:
(1)下列与方案③相关的叙述中,正确的是ACD(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
(2)方案③中,当Fe3+全沉淀时,溶液中c(Cu2+)的范围为≤2.2mol/L.
9.下列氢氧化物中,碱性最强的是( )
| A. | Ca(OH)2 | B. | NaOH | C. | KOH | D. | Al(OH)3 |
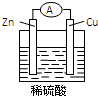 Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.
Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.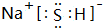 ,B中含有的化学键类型是离子键、共价键.
,B中含有的化学键类型是离子键、共价键.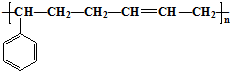 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )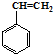 ②
②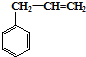 ③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2.
③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2.