题目内容
3.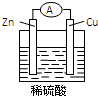 Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.
Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.
分析 Cu、Zn原电池中,Zn失去电子发生氧化反应作负极,正极上氢离子得到电子发生还原反应生成氢气,以此来解答.
解答 解:Cu、Zn原电池中,Zn失去电子作负极,被氧化,发生氧化反应,其电极反应式为:Zn-2e-=Zn2+,正极上氢离子得到电子生成氢气,发生还原反应,电极反应为2H++2e-=H2↑,总反应式为Zn+H2SO4═ZnSO4+H2↑,故答案为:Zn;2H++2e-═H2↑;还原反应;Zn+H2SO4═ZnSO4+H2↑.
点评 本题考查原电池,明确原电池中的能量转化及电极反应是解答本题的关键,注重基础知识的考查,题目较简单.

练习册系列答案
相关题目
13.下列化学用语书写正确的是( )
| A. | 次氯酸的电离方程式:HClO?H++ClO- | |
| B. | 铝溶于烧碱溶液的离子方程式:Al+2OH-═AlO2-+H2↑ | |
| C. | 电解精炼铜的阴极反应式:Cu-2e-═Cu2+ | |
| D. | 已知中和热为57.3 kJ•mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=+114.6 kJ•mol-1 |
14.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以上推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以上推测正确的是( )
| A. | 一定有SO32-离子 | B. | 不一定有CO32-离子 | ||
| C. | 不能确定Cl-离子是否存在 | D. | 不能确定HCO3-离子是否存在 |
11.下列化学用语的理解正确的是( )
| A. | 某离子结构示意图为: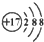 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式为: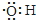 ,可以表示羟基,也可以表示氢氧根离子 ,可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型为: ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 晶体锗的结构为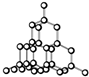 ,其晶胞可表示为 ,其晶胞可表示为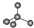 |
8.下列反应后只可能生成一种有机物的是( )
| A. | CH3-CH=CH2与HCl加成 | |
| B. | C6H5-CH3在铁粉存在下与氯气反应 | |
| C. | CH3-CH2-CHBr-CH3在氢氧化钠乙醇溶液中加热反应 | |
| D. | CH3-CHOH-CH3在浓硫酸存在下,发生分子内脱水 |
15.在共价化合物中元素化合价有正负,其主要原因是( )
| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有电子对偏移 | D. | 含有多种非金属元素 |
