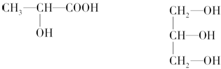题目内容
9.下列氢氧化物中,碱性最强的是( )| A. | Ca(OH)2 | B. | NaOH | C. | KOH | D. | Al(OH)3 |
分析 元素的金属性越强,其最高价氧化物的水化物碱性越强;同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱,据此分析解答.
解答 解:元素的金属性越强,其最高价氧化物的水化物碱性越强;同一主族元素,元素的金属性随着原子序数增大而增强,同一周期元素,元素的金属性随着原子序数增大而减弱,所以金属性K>Ca>Na>Al,所以最高价氧化物的水化物碱性KOH最强,故选C.
点评 本题考查溶液碱性强弱判断,明确金属性强弱与其最高价氧化物的水化物碱性强弱关系是解本题关键,知道金属性强弱与失电子难易程度有关,与失电子多少无关,为易错点.

练习册系列答案
相关题目
17.下列关于工业生产的说法中正确的是( )
| A. | 硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 | |
| B. | 氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 | |
| C. | 工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率 | |
| D. | 电解精炼铜时,纯铜作为阳极,粗铜作为阴极 |
4.如图所示装置最适宜用于观测( )


| A. | NaCl溶液的密度 | B. | NaCl溶液的浓度 | ||
| C. | NaCl溶液的酸碱性 | D. | NaCl溶液的导电性 |
1.下列有关实验及操作的叙述中,错误的是( )
| A. | 用水将苯、乙酸、四氯化碳区分开来 | |
| B. | 在实验室中通常将钠保存在汽油里 | |
| C. | 用稀硝酸洗去残留在试管壁上的银 | |
| D. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗涤 |
19.依据题目要求回答下列问题.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+ 能力最强的是CO32-.
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
 ,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).
,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).