题目内容
1.将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )
| A. | 该温度下,反应的平衡常数数值约为7.36 | |
| B. | 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 | |
| C. | 反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol•L-1•s-1 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小 |
分析 根据图II知,生成物总能量小于反应物总能量,则该反应的正反应是放热反应;
A.根据方程式知,该反应前后气体计量数之和不变,所以反应达到平衡时混合气体物质的量不变为3mol,C的体积分数为0.3,则n(C)=3mol×3=0.9mol,n(D)=n(C)=0.9mol,n(A)=(1-0.9)mol=0.1mol,n(B)=(2-0.9)mol=1.1mol,则c(D)=c(C)=$\frac{0.9mol}{2L}$=0.45mol/L,c(A)=$\frac{0.1mol}{2L}$=0.05mol/L,
c(B)=$\frac{1.1mol}{2L}$=0.55mol/L,化学平衡常数=$\frac{c(C).c(D)}{c(A).c(B)}$;
B.恒温条件下,缩小容器体积,增大压强,反应速率增大,但平衡不移动,则平衡时C含量不变;
C.反应在第4秒钟达到化学平衡状态,0~4秒内,以v(C)=$\frac{\frac{3mol×0.3}{2L}}{4s}$=0.1125 mol•L-1•s-1,同一反应中同一时间段内各物质的反应速率之比等于其计量数之比;
D.加入催化剂,能同等程度的增大正逆反应速率,但平衡不移动,活化能降低.
解答 解:根据图II知,生成物总能量小于反应物总能量,则该反应的正反应是放热反应;
A.根据方程式知,该反应前后气体计量数之和不变,所以反应达到平衡时混合气体物质的量不变为3mol,C的体积分数为0.3,则n(C)=3mol×3=0.9mol,n(D)=n(C)=0.9mol,n(A)=(1-0.9)mol=0.1mol,n(B)=(2-0.9)mol=1.1mol,则c(D)=c(C)=$\frac{0.9mol}{2L}$=0.45mol/L,c(A)=$\frac{0.1mol}{2L}$=0.05mol/L,
c(B)=$\frac{1.1mol}{2L}$=0.55mol/L,化学平衡常数=$\frac{c(C).c(D)}{c(A).c(B)}$=$\frac{0.45×0.45}{0.05×0.55}$=7.36,故A正确;
B.恒温条件下,缩小容器体积,增大压强,反应速率增大,但平衡不移动,则平衡时C含量不变,则可以使反应的过程按图Ⅰ中a曲线进行,故B正确;
C.反应在第4秒钟达到化学平衡状态,0~4秒内,以v(C)=$\frac{\frac{3mol×0.3}{2L}}{4s}$=0.1125 mol•L-1•s-1,同一反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以0~4秒内,以A表示的化学反应速率是:0.1125 mol•L-1•s-1,故C错误;
D.加入催化剂降低反应的活化能,则E1和E2均减小,化学反应速率增大,故D正确;
故选C.
点评 本题考查化学平衡有关计算,为高频考点,侧重考查学生发生计算能力,难点是平衡常数的计算,易错选项是D.

 阅读快车系列答案
阅读快车系列答案| A. | 元素周期表中位于金属与非金属分界线附近的元素,既表现金属性,又表现非金属性 | |
| B. | 同主族元素的原子,最外层电子数相同,化学性质相似 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价都等于它的族序数 |
| A. | 短周期是指笫1、2周期 | B. | 过渡元素全部是金属元素 | ||
| C. | I A族的元索全部是金属元素 | D. | 元素周期表有8个副族 |
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有 0.4 mol电子转移,则在标准状况下消耗 4.48 L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
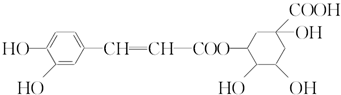
| A. | 分子式为C16H18O9 | |
| B. | 0.1 mol绿原酸最多与0.8 mol NaOH反应 | |
| C. | 能与Na2CO3反应 | |
| D. | 能发生取代反应和消去反应 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向溶液中先滴加BaCl2溶液,再滴加稀盐酸 | 滴加BaCl2后出现白色沉淀,再滴加稀盐酸沉淀不溶解 | 溶液中一定含有SO42- |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |

| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y是气态氢化物稳定性小于Z的气态氢化物 | |
| C. | Z一定是活泼的金属 | |
| D. | 1molZ单质在足量的氧气中燃烧时,有6mol电子发生转移 |
| A. | SO3 | B. | NO2 | C. | Si | D. | CH3COOH |
| A. | 加热 | |
| B. | 加入少量CuSO4溶液 | |
| C. | 不用稀硫酸,改用质量分数为98%的浓硫酸 | |
| D. | 不用铁片,改用铁粉 |