题目内容
11.实验室可以用铁片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )| A. | 加热 | |
| B. | 加入少量CuSO4溶液 | |
| C. | 不用稀硫酸,改用质量分数为98%的浓硫酸 | |
| D. | 不用铁片,改用铁粉 |
分析 增大金属与酸反应的化学反应速率,可通过增大浓度、升高温度或形成原电池反应等措施,注意浓硫酸和铁发生钝化反应.
解答 解:A.温度升高,反应速率增大,故A不选;
B.滴加少量CuSO4溶液,铁置换出铜,形成原电池反应,可加快反应速率,故B不选;
C.改用浓硫酸溶液,浓硫酸和铁发生钝化反应,不能生成氢气,反应速率减小甚至为0,故C选;
D.改用铁粉,增大了反应物的接触面积,反应速率加快,故D不选.
故选C.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意浓硫酸与铁在常温下发生钝化.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
1.将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )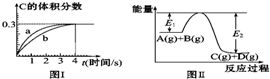

| A. | 该温度下,反应的平衡常数数值约为7.36 | |
| B. | 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 | |
| C. | 反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol•L-1•s-1 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小 |
19.下列有关叙述不正确的是( )
| A. | C02分子中σ键和π键之比为1:1 | |
| B. | PCl5中所有原子均满足8电子稳定结构 | |
| C. | 由于HCOOH分子间存在氢键,则同压下,HC00H的沸点比CH3OCH3的高 | |
| D. | CH2=CH-CHO分子中碳原子的杂化类型均为sp2 |
6.下列化学用语正确的是( )
| A. | 聚乙烯的结构简式: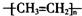 | B. | CH4分子的填充(或比例)模型: | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 8个中子的碳原子的核素符号:12C |
16.中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙→丙+丁.下列说法正确的是( )
| A. | 若甲为铜,丁为氯化亚铁,则该反应为置换反应 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为三氧化二铝,则丙可能是镁 | |
| D. | 若甲为NH4+,乙为OH-,则甲、乙、丙、丁4种粒子均含10个电子 |
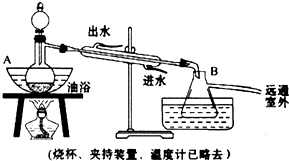
1.如图所示为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )


| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸 | |
| B. | 试管b中导气管下端管口不能侵入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a需小心均匀加热的原因是避免液体剧烈沸腾,减少乙醇,乙酸的挥发,防止温度过高时发生炭化 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙酯 |
 后静置,放出水层(废液).
后静置,放出水层(废液).