题目内容
6.如表实验操作、现象与结论对应关系正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向溶液中先滴加BaCl2溶液,再滴加稀盐酸 | 滴加BaCl2后出现白色沉淀,再滴加稀盐酸沉淀不溶解 | 溶液中一定含有SO42- |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下,Fe2+被NO3-氧化生成Fe3+,NO3-被还原生成NO,NO不稳定易被氧化生成NO2;
B.和BaCl2溶液反应生成白色不溶于稀盐酸的沉淀还可能是AgCl;
C.盐类水解是吸热反应,升高温度促进水解;
D.葡萄糖和新制氢氧化铜悬浊液反应必须在碱性条件下.
解答 解:A.酸性条件下,Fe2+被NO3-氧化生成Fe3+,NO3-被还原生成NO,NO不稳定易被氧化生成NO2,导致试管口出现红棕色气体,故A错误;
B.和BaCl2溶液反应生成白色不溶于稀盐酸的沉淀还可能是AgCl,所以溶液中还可能含有银离子,故B错误;
C.0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热,红色加深,说明溶液碱性增强,则升高温度促进盐类水解,所以盐类水解是吸热反应,故C正确;
D.葡萄糖和新制氢氧化铜悬浊液反应必须在碱性条件下,在滴加氢氧化铜悬浊液之前要滴加NaOH溶液,否则实验不成功,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、氧化还原反应、官能团检验、盐类水解等知识点,明确实验原理是解本题关键,注意离子检验要排除其它离子干扰,易错选项是D.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
16.下列物质能导电的是( )
| A. | 氯化氢气体 | B. | 无水酒精 | C. | 熔融的氯化钠 | D. | 硫酸铜晶体 |
17.若甲、丙为同主族元素的单质,乙、丁为氧化物,它们之间的转化关系为甲+乙→丙+丁,则满足条件的甲和丙为( )
| A. | 钠和氢气 | B. | 氯气和溴 | C. | 铝和铁 | D. | 碳和硅 |
1.将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )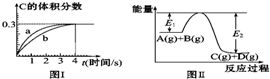

| A. | 该温度下,反应的平衡常数数值约为7.36 | |
| B. | 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 | |
| C. | 反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol•L-1•s-1 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小 |
18.煤化工是以煤 为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工 产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
①实验1中以v(CO2) 表示的反应速率为0.16mol•(L•min)-1.
②该反应的逆反应为吸热(填“吸”或“放”)热反应
③该反应平衡常数的数学表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$表中x=$\frac{4}{3}$; y=$\frac{8}{3}$.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 3 | 0.75 | 2.25 | 3 |
| 3 | 900 | 2 | 4 | x | y | t |
②该反应的逆反应为吸热(填“吸”或“放”)热反应
③该反应平衡常数的数学表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$表中x=$\frac{4}{3}$; y=$\frac{8}{3}$.
15. 116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
 116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )| A. | 属第17族元素 | B. | 属非金属元素 | ||
| C. | 原子核外有117个电子 | D. | 有放射性 |
16.中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙→丙+丁.下列说法正确的是( )
| A. | 若甲为铜,丁为氯化亚铁,则该反应为置换反应 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为三氧化二铝,则丙可能是镁 | |
| D. | 若甲为NH4+,乙为OH-,则甲、乙、丙、丁4种粒子均含10个电子 |
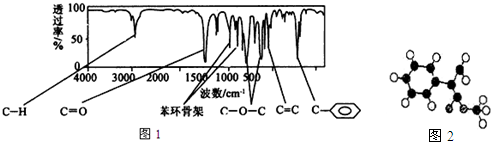
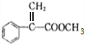 .
.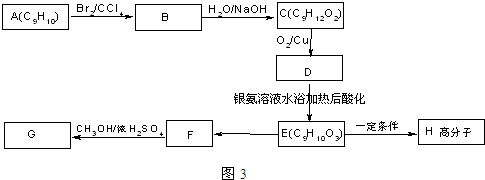
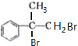 +2NaOH$→_{水}^{△}$
+2NaOH$→_{水}^{△}$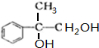 +2NaBr C→D
+2NaBr C→D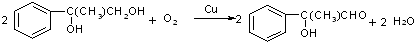 E→Hn
E→Hn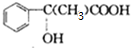 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O
+(n-1)H2O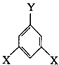 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式: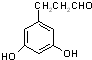 、
、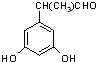 、
、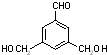 、
、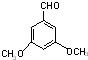 .
.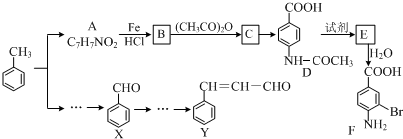
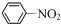 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$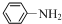
 +(CH3CO)2O→
+(CH3CO)2O→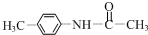 +CH3COOH.在合成F的过程中,B→C步骤不能省略,理由是氨基易被氧化,在氧化反应之前需先保护氨基.
+CH3COOH.在合成F的过程中,B→C步骤不能省略,理由是氨基易被氧化,在氧化反应之前需先保护氨基.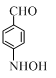 、
、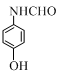 、
、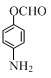 (写出3个).
(写出3个).