题目内容
9.汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb(s)+SO42-(aq)-2e -=PbSO4(s) | |
| C. | 铅蓄电池属于一次电池 | |
| D. | 电池放电时,溶液酸性增强 |
分析 A、蓄电池放电时,该装置是原电池,根据电极上发生反应的反应类型判断正负极;
B、根据电池反应式确定负极上的电极反应式;
C、根据一次电池和二次电池的概念分析;
D、根据电池反应式判断溶液的变化来确定溶液酸碱性的变化.
解答 解:A、蓄电池放电时,该装置是原电池,负极上失电子发生氧化反应,该装置中Pb失电子发生氧化反应,所以Pb是负极,故A错误;
B、负极上Pb失电子和硫酸根离子反应生成硫酸铅,即Pb(s)+SO42-(aq)-2e-=PbSO4(s),故B正确;
C、放电后可以再充电使活性物质获得再生的电池为二次电池,所以铅蓄电池为二次电池,故C错误;
D、电池放电时,硫酸参加反应生成水,所以溶质的质量减少,溶剂的质量增加,所以溶液酸性减弱,故D错误;
故选B.
点评 本题考查了二次电池的有关知识,难度不大,注意根据反应方程式判断电解池和原电池.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
19.以下有机物:
(1)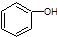 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
请将它所对应的物质类别填入下列表格中并写出官能团名称
(1)
 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH请将它所对应的物质类别填入下列表格中并写出官能团名称
| 物质序号 | 物质类别 | 官能团名称 | 物质序号 | 物质类别 | 官能团名称 |
| (1) | (4) | ||||
| (2) | (5) | ||||
| (3) | (6) |
17.某有机物除含碳氢元素外,可能含有氧元素.取该物质a g在足量O2 中充分燃烧后,在120℃下将产物全部通过足量的过氧化钠,充分反应后,过氧化钠固体质量也增加ag.则下列说法正确的是( )
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
14.下列说法正确的是( )
| A. | 按系统命名法,有机物 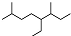 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为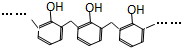 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
1.科学家最近发现两种粒子;第一种是只由四个中子构成的粒子,这种粒子称为“四中子”也有人称之为“零号元素”.第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是( )
| A. | 第二种粒子是氧元素的另一种核素 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
18.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得(已知在中学阶段羧基、酯基、酰胺基(-CONH-)不与氢气发生加成反应,给特殊信息除外,下同):
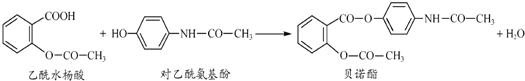
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 1mol贝诺酯分子可与6molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
19.实验室进行:Cu+2H2SO4(浓)$\stackrel{△}{→}$CuSO4+SO2↑+2H2O,反应因硫酸浓度下降而停止.为测定反应残余液中硫酸的浓度,探究小组同学设计了4组实验方案(将残余液稀释至1L,每次均量取20mL稀释液进行实验),其中可行的是( )
| A. | 加入足量BaCl2溶液反应,过滤、洗涤、干燥、恒重,称得固体质量为W1 g | |
| B. | 加入过量的W2 g Zn充分反应后,过滤、洗涤、干燥、恒重,称得固体质量为W3 g | |
| C. | 加入过量的W4 g CaCO3反应停止后,过滤、洗涤、干燥、恒重,称得固体质量为W5 g | |
| D. | 滴入适当指示剂,用已知浓度的NaOH溶液进行滴定,消耗NaOH溶液的体积为V mL |
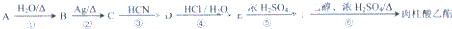
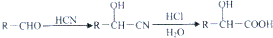
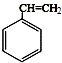 ,肉酸乙酯的结构简式
,肉酸乙酯的结构简式 .
. .
.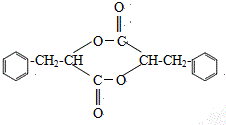 ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.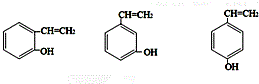 (填结构简式).
(填结构简式).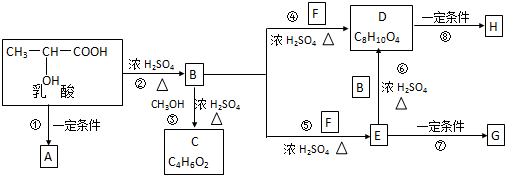
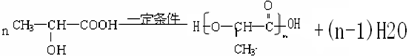 .
.