题目内容
7.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | NH3 | Ca(Cl)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | SO2 | Ba(NO3)2 |
| A. | ②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④ |
分析 ①石灰水过量,生成碳酸钙沉淀、亚硫酸钙沉淀;
②氢氧化钙过量,生成碳酸钙沉淀;
③CO2、NH3反应生成碳酸铵或碳酸氢铵,碳酸铵与氯化钙反应生成碳酸钙沉淀;
④NO2、SO2在水溶液中发生氧化还原反应生成硫酸根离子,再与氯化钡反应生成沉淀;
⑤SO2与Ba(NO3)2发生氧化还原反应生成硫酸钡沉淀.
解答 解:①石灰水过量,发生酸性氧化物与碱的反应生成碳酸钙沉淀、亚硫酸钙沉淀,故正确;
②氢氧化钙过量,与二氧化碳反应生成碳酸钙沉淀,故正确;
③CO2、NH3反应生成碳酸铵,再与氯化钙发生复分解反应生成碳酸钙沉淀,若生成碳酸氢铵与氯化钙不反应生成沉淀,故错误;
④NO2、SO2在水溶液中发生氧化还原反应生成硫酸根离子,再与氯化钡反应生成硫酸钡沉淀,故正确;
⑤SO2与Ba(NO3)2发生氧化还原反应生成硫酸钡沉淀,故正确.
故选B.
点评 本题考查二氧化硫和二氧化碳的化学性质,为高频考点,把握酸性氧化物的性质、酸性的比较、氧化还原反应等为解答的关键,注意发生的化学反应,题目难度不大.

练习册系列答案
相关题目
18.电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4.下列判断错误的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 原子半径:X>Y>Z | ||
| C. | 非金属性:X>Y>Z | D. | 单质氧化性:X>Y>Z |
2.参照反应Br+H?HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
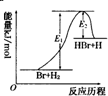

| A. | 该反应的反应热△H=E2-E1 | |
| B. | 加入催化剂,该化学反应的反应热和平衡常数变大 | |
| C. | 正反应的吸热反应 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
19.以下有机物:
(1)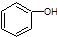 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
请将它所对应的物质类别填入下列表格中并写出官能团名称
(1)
 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH请将它所对应的物质类别填入下列表格中并写出官能团名称
| 物质序号 | 物质类别 | 官能团名称 | 物质序号 | 物质类别 | 官能团名称 |
| (1) | (4) | ||||
| (2) | (5) | ||||
| (3) | (6) |
16.每种物质都既有离子键,又有共价键的一组物质是( )
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | MgO、Na2SO4、NH4HCO3 | ||
| C. | Na2O2、NH4Cl、Na2SO4 | D. | HCl、Al2O3、MgCl2 |
17.某有机物除含碳氢元素外,可能含有氧元素.取该物质a g在足量O2 中充分燃烧后,在120℃下将产物全部通过足量的过氧化钠,充分反应后,过氧化钠固体质量也增加ag.则下列说法正确的是( )
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
 A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
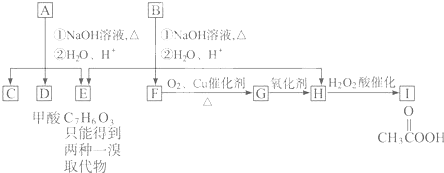
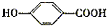 .
. 或
或 .
.