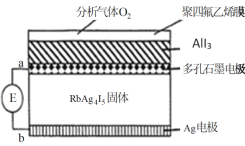
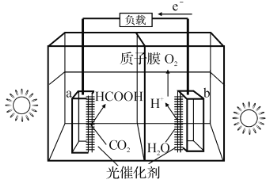
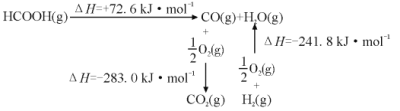
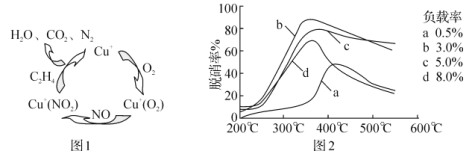
题目内容
【题目】关于反应3Cl2+6KOH![]() KClO3+5KCl+3H2O,以下说法正确的是( )
KClO3+5KCl+3H2O,以下说法正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.被氧化的氯元素的质量是被还原的氯元素质量的5倍
C.3 mol氯气参加反应转移6 mol电子
D.KOH、KCl和KClO3 都是电解质
【答案】D
【解析】
反应3Cl2+6KOH![]() KClO3+5KCl+3H2O中Cl元素的化合价由0价升高为+5价,失去电子被氧化,Cl元素的化合价由0价降低为-1价,得到电子被还原,据此分析解答。
KClO3+5KCl+3H2O中Cl元素的化合价由0价升高为+5价,失去电子被氧化,Cl元素的化合价由0价降低为-1价,得到电子被还原,据此分析解答。
A.根据上述分析可知,只有Cl元素的化合价发生改变,因此Cl2是氧化剂,也是还原剂,A选项错误;
B.根据得失电子守恒可知,被还原的氯元素的质量是被氧化的氯元素质量的5倍,B选项错误;
C.由Cl元素的化合价变化可知反应中每3个Cl2分子中有5个电子转移,C选项错误;
D.KOH属于碱,KCl和KClO3属于盐,三者在水溶液中均能电离出离子导电,属于电解质,D选项正确;
答案选D。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D