题目内容
【题目】甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
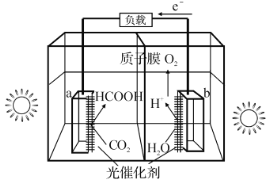
该装置能量转化方式为___。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2 慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2 快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
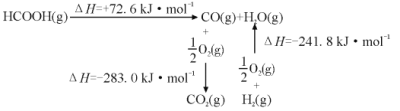
反应CO2(g)+H2(g) HCOOH(g)的焓变△H=___kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___(以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___T1℃时平衡压强(填“>”“<”或“=”),理由是___。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
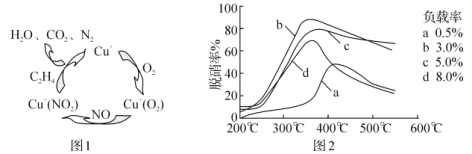
①写出该脱硝原理总反应的化学方程式:___。
②为达到最佳脱硝效果,应采取的条件是___。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___(T℃时甲酸的电离常数为2×10-4)。
【答案】光能转化为化学能和电能 ACD -31.4 0.5k正 > CO2(g)+H2(g) HCOOH(g)为放热反应,温度升高,平衡常数减小,平衡左移,气体的物质的量增加,总压强增大;温度升高,总压强增大 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O 350℃、负载率3.0% 1.6×10-5
3N2+4CO2+4H2O 350℃、负载率3.0% 1.6×10-5
【解析】
(1)根据图示分析能量的转化方式;
(2)根据第一步能够快速平衡,第二步为慢反应,第三步反应为快反应,结合反应方程式和反应速率的影响因素分析判断;
(3)①由图示可知①HCOOH(g)CO (g)+H2O(g)△H=+72.6kJ/mol,②CO(g)+![]() O2(g)=CO2(g)△H= -283.0kJ/mol,③H2(g)+
O2(g)=CO2(g)△H= -283.0kJ/mol,③H2(g)+ ![]() O2(g)=H2O(g)△H= -241.8kJ/mol,再利用盖斯定律分析解答;②反应达到化学平衡时,有v正=v逆,根据速率方程和化学平衡常数表达式分析计算;③根据平衡常数的变化判断平衡移动的方向结合温度的变化分析解答;
O2(g)=H2O(g)△H= -241.8kJ/mol,再利用盖斯定律分析解答;②反应达到化学平衡时,有v正=v逆,根据速率方程和化学平衡常数表达式分析计算;③根据平衡常数的变化判断平衡移动的方向结合温度的变化分析解答;
(4)①根据图1确定反应物、生成物,写出反应方程式;②为达到最佳脱硝效果,需要满足脱硝率高,负载率低,适宜的温度选择合适的条件;
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO-HCOO-+CH3COOH,该反应的平衡常数为12.5,即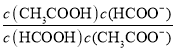 =12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=
=12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=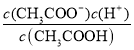 ,据此分析计算。
,据此分析计算。
(1)根据图示,该装置能量转化方式为光能转化为化学能和电能,故答案为:光能转化为化学能和电能;
(2)A.第一步能够快速平衡,第二步为慢反应,因此平衡时v(第一步的逆反应)>v(第二步反应),故A正确;B.根据反应原理,反应的中间产物只有Ru(OOCH)2、RuH2和H2O,故B错误;C.第二步反应为慢反应,说明反应中RuH2与CO2的碰撞仅部分有效,故C正确;D.第三步反应为快反应,说明反应的活化能较低,反应容易进行,故D正确;故答案为:ACD;
(3)由图示可知①HCOOH(g)CO (g)+H2O(g)△H=+72.6kJ/mol,②CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJ/mol,③H2(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol,③H2(g)+![]() O2(g)=H2O(g)△H=-241.8kJ/mol,根据盖斯定律,将①+②-③可得HCOOH(g)CO2 (g)+H2(g) 的焓变△H=(+72.6kJ/mol)+(-283.0kJ/mol)-(-241.8kJ/mol)=+31.4kJ/mol,则CO2(g)+H2(g) HCOOH(g)的焓变△H= -31.4kJ/mol,故答案为:-31.4;
O2(g)=H2O(g)△H=-241.8kJ/mol,根据盖斯定律,将①+②-③可得HCOOH(g)CO2 (g)+H2(g) 的焓变△H=(+72.6kJ/mol)+(-283.0kJ/mol)-(-241.8kJ/mol)=+31.4kJ/mol,则CO2(g)+H2(g) HCOOH(g)的焓变△H= -31.4kJ/mol,故答案为:-31.4;
②反应CO2(g)+H2(g) HCOOH(g)达到化学平衡时,有v正=v逆,即k正c(CO2)c(H2)=k逆c(HCOOH),所以![]() =
=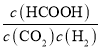 =2,所以k正=2k逆,即k逆=0.5k正,故答案为:0.5k正;
=2,所以k正=2k逆,即k逆=0.5k正,故答案为:0.5k正;
③当温度改变为T2时,k正=1.9k逆,则K=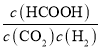 =
=![]() =1.9<2,说明平衡逆向移动,气体的物质的量增大,总压强增大;该反应的正反应为放热反应,温度升高,平衡逆向移动,所以温度T2>T1,温度升高,总压强增大,故答案为:>;CO2(g)+H2(g) HCOOH(g)为放热反应,温度升高,平衡常数减小,平衡左移,气体的物质的量增加,总压强增大;温度升高,总压强增大;
=1.9<2,说明平衡逆向移动,气体的物质的量增大,总压强增大;该反应的正反应为放热反应,温度升高,平衡逆向移动,所以温度T2>T1,温度升高,总压强增大,故答案为:>;CO2(g)+H2(g) HCOOH(g)为放热反应,温度升高,平衡常数减小,平衡左移,气体的物质的量增加,总压强增大;温度升高,总压强增大;
(4)①由图1知,反应物为一氧化氮、氧气、乙烯,铜为催化剂,生成物为氮气、二氧化碳和水,反应的化学方程式为6NO+3O2+2C2H4 ![]() 3N2+4CO2+4H2O,故答案为:6NO+3O2+2C2H4
3N2+4CO2+4H2O,故答案为:6NO+3O2+2C2H4 ![]() 3N2+4CO2+4H2O;
3N2+4CO2+4H2O;
②为达到最佳脱硝效果,需要满足脱硝率高,负载率低,适宜的温度,由图可知,合适的条件为350℃、负载率3%,故答案为:350℃、负载率3%;
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,即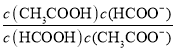 =12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=
=12.5,则该温度下醋酸的电离常数Ka(CH3COOH)= 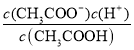 =
=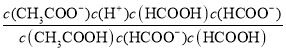 =
=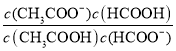 ×
×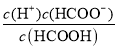 =
=![]() ×2×10-4=1.6×10-5,故答案为:1.6×10-5。
×2×10-4=1.6×10-5,故答案为:1.6×10-5。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案