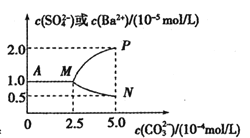
题目内容
【题目】![]() 时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
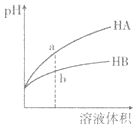
A.水的电离程度:a点小于b点
B.a点溶液的导电性大于b点溶液
C.恰好完全中和时,所需NaOH物质的量:![]()
D.HA的酸性强于HB
【答案】D
【解析】
pH相同的酸,稀释相同倍数时,酸性较强的酸的pH变化大,酸性较弱的酸的pH变化小,据此得出酸性:HA>HB。
A. a点pH大于b点,即a点的c(H+)小于b点,则酸的电离对水的电离的抑制程度:a点小于b点,所以水的电离程度:a点大于b点,A项错误;
B. 在这两种酸溶液中,c(H+)≈c(A),c(H+)≈c(B),而a点的c(H+)小于b点的c(H+),故a点的c(A)小于b点的c(B),即a点的离子浓度小于b点的离子浓度,故a点的导电能力小于b点,B项错误;
C. 在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在稀释前两种酸溶液的浓度:c(HA)<c(HB),故将溶液稀释相同倍数时,酸的浓度仍有:c(HA)<c(HB),故a点酸的总浓度小于b点酸的总浓度,所以二者恰好完全中和,所需NaOH物质的量不一样,C项错误;
D. pH相同的酸,稀释相同倍数时,酸性较强的酸的pH的变化大,酸性较弱的酸的pH的变化小,故HA的酸性强于HB的酸性,D项正确;
答案选D。

【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为______;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:2H2(g)+2CO(g)CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为______,随着反应的进行速率逐渐减慢的可能原因是________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)