题目内容
5.室温下测得甲醛、乙醛和丙酮组成的液态混合物中氢元素的质量分数为9.8%,则该混合物的氧元素的质量分数为( )| A. | 52.2% | B. | 31.4% | C. | 30% | D. | 27.5% |
分析 甲醛为CH2O,乙醛为C2H4O,丙酮为C3H6O,各分子中碳原子与氢原子数目之比为1:2,所以混合物中C、H元素质量之比为12::2=6:1,根据氢元素的质量分数计算C元素质量分数,混合物中w(O)=1-w(H)-w(C).
解答 解:甲醛为CH2O,乙醛为C2H4O,丙酮为C3H6O,各分子中碳原子与氢原子数目之比为1:2,所以混合物中C、H元素质量之比为12::2=6:1,混合物中氢元素的质量分数为9.8%,则C元素质量分数为9.8%×6=58.8%,故混合物中氧元素质量分数=1-9.8%-58.8%=31.4%,故选B.
点评 本题考查混合物质量分数的计算,难度不大,关键是根据各物质的分子式确定C、H元素质量之比,侧重考查学生分析计算能力.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
1.酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示.下列表述不正确的是( )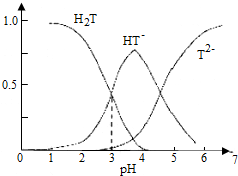

| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
16.关于金属冶炼的叙述正确的是( )
| A. | 工业上可利用铝热反应大量冶炼金属铁 | |
| B. | 金属钠、铝和铜都可用还原法制备 | |
| C. | 电解饱和氯化镁溶液可得金属镁 | |
| D. | 用足量CO还原磁铁矿得到9 mol铁时转移24 mol电子 |
20.欲除去甲烷中混有的少量乙烯气体,可以通过装有下列哪种试剂的洗气瓶( )
| A. | 氢氧化钠溶液 | B. | 极稀的溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 水 |
10.下列物质的沸点由高到低排列的顺序是( )
①CH3(CH2)2CH3;
②CH3(CH2)3CH3;
③(CH3)3CH;
④CH3CH2CH3;
⑤CH3(CH2)4CH3.
①CH3(CH2)2CH3;
②CH3(CH2)3CH3;
③(CH3)3CH;
④CH3CH2CH3;
⑤CH3(CH2)4CH3.
| A. | ⑤③①②④ | B. | ⑤②①③④ | C. | ⑤①③②④ | D. | ②⑤③①④ |
14.A、B、C、D、E为五种短周期元素.A、B、C是原子序数依次递增的同周期元素,且最外层电子数之和为15,A与C可形成AC2分子;B与D形成的气态化合物在标况下的密度为0.76g/L;E的质子数是A、B、C、D四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | B的最简气态氢化物的热稳定性比A的强是因为其最简气态氢化物分子间存在氢键 | |
| B. | 由A元素构成的单质均具有熔点高、硬度大的特性 | |
| C. | 常温下E与D元素形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由A、B、C、D四种元素形成的化合物一定既有离子键,又有共价键 |
15.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇与钠反应的速率小于水与钠的反应速率 | |
| C. | 在光照条件下,甲烷可与氯气发生取代反应,甲苯也可以 | |
| D. | 苯酚中的羟基能与NaOH溶液反应,而醇羟基不能与NaOH溶液反应 |