题目内容
17.(1)下列实验操作或叙述正确的是AHI(填字母)A.向饱和苯酚钠溶液中,不断通入足量二氧化碳气体,溶液最终呈浑浊
B.用金属钠检验无水乙醇中含有的少量水
C.除去乙烷中少量的乙烯:与适量的氢气混合加热,把乙烯转化为乙烷
D.向苯酚浓溶液中滴入少量浓溴水可观察到白色的三溴苯酚沉淀
E.用氨水洗去试管内壁的银镜
F.证明氯乙烷分子中含有氯原子,可将氯乙烷溶于AgNO3的HNO3溶液中
G.乙醇与氢溴酸的反应中断裂了O-H 键
H.甲醛与苯酚制取酚醛树脂的反应属于聚合反应
I.实验室制取乙烯气体时,将温度计的水银球放入液面下
(2)化合物A(C4H8Br2)可由下列反应制得,C4H10O$\stackrel{浓硫酸、加热}{→}$C4H8 $\stackrel{溴的四氯化碳溶液}{→}$C4H8Br2,则结构式不可能的是B
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br.
分析 (1)A、根据苯酚酸性比碳酸弱判断;
B、乙醇和水都可与钠反应;
C、乙烯与氢气的加成反应在实验室难以完成;
D、向苯酚浓溶液中滴入少量浓溴水会发生反应,得到的产物溶于苯酚中;
E、氨水和试管内壁的银不会发生反应;
F、氯乙烷溶于AgNO3的HNO3溶液中不会发生反应;
G、乙醇与氢溴酸的反应生成溴乙烷和水;
H、甲醛与苯酚制取酚醛树脂的反应属于聚合反应中的缩聚反应;
I、实验室制取乙烯气体时,加热混合液温度至170℃.
(2)由转化关系可知,C4H10O在浓硫酸、加热的条件下发生消去反应生成C4H8,C4H10O为醇,C4H8为烯烃,烯烃与溴发生加成反应生成A,A中2个溴原子应分别连接在相邻的碳原子上,结合C4H8的烯烃同分异构体进行判断.
解答 解:(1)A、向饱和苯酚钠溶液中,不断通入足量二氧化碳气体,溶液最终呈浑浊,产生苯酚,故正确;
B、乙醇和水都可与钠反应,应用无水硫酸铜检验,故错误;
C、乙烯与氢气的加成反应应在催化剂条件下进行,在实验室难以完成,且易引入新杂质,应用溴水除杂,故错误;
D、向苯酚浓溶液中滴入少量浓溴水,会发生反应,产生白色的三溴苯酚沉淀,但是该沉淀会溶于苯酚中,故错误;
E、氨水和试管内壁的银不会发生反应,故错误;
F、氯乙烷溶于AgNO3的HNO3溶液中不会发生反应,氯乙烷中不存在氯离子,故错误;
G、乙醇与氢溴酸的反应生成溴乙烷和水断裂了O-C 键,故错误;
H、甲醛与苯酚制取酚醛树脂的反应属于聚合反应中的缩聚反应,故正确;
I、实验室制取乙烯气体时,加热混合液温度至170℃,将温度计的水银球放入液面下,故正确.
故选AHI.
(2)解:由转化关系可知,C4H10O在浓硫酸、加热的条件下发生消去反应生成C4H8,C4H10O为醇,C4H8为烯烃,
A.若C4H8为CH3CH2CH=CH2,与溴发生加成反应生成CH3CH2CHBrCH2Br,故A正确;
B.分子中2个溴原子不是分别连接在相邻的碳原子上,不可能是烯烃与溴的基础产物,故B错误;
C.若C4H8为CH3CH=CHCH3,与溴发生加成反应生成CH3CHBrCHBrCH3,故C正确;
D.若C4H8为(CH3)2C=CH2,与溴发生加成反应生成(CH3)2CBrCH2Br,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的分离、提纯、检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,为解答该题的关键,答题时属于实验的严密性和可行性的评价,难度不大.

| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的氧化铜与CO的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
| A. | 52.2% | B. | 31.4% | C. | 30% | D. | 27.5% |
| A. | 凡是卤代烃一定能发生消去反应 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| D. | 苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚弱 |
| A. | n-5 | B. | n+3 | C. | n+13 | D. | n-13 |
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-)
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>H2SiO3
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ① | B. | ①③ | C. | ②③④⑤⑥⑦ | D. | ①③⑤ |
| A. | CH3CH(C2H5)CH3:2-甲基丁烷 | B. |  :2-甲基-1-丙醇 | ||
| C. | CH2BrCH2Br:二溴乙烷 | D. |  :2,2二甲基丁酸 |
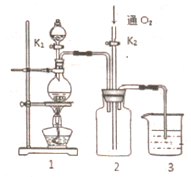 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示) (1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;
(1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;