题目内容
16.关于金属冶炼的叙述正确的是( )| A. | 工业上可利用铝热反应大量冶炼金属铁 | |
| B. | 金属钠、铝和铜都可用还原法制备 | |
| C. | 电解饱和氯化镁溶液可得金属镁 | |
| D. | 用足量CO还原磁铁矿得到9 mol铁时转移24 mol电子 |
分析 A、铝热反应是金属铝和沸点较高的金属氧化物之间反应冶炼高熔点金属的过程,结合金属铁的工业制备原理来回答;
B、活泼金属钠、镁、铝在工业上采用电解法来冶炼;
C、电解熔融氯化镁可以获得金属镁;
D、根据反应中元素化合价的升降以及电子守恒来计算.
解答 解:A、铝热反应是可以用来冶炼高熔点金属,如金属铁,但是大量金属铁的冶炼是采用还原法,故A错误;
B、金属钠、铝等活泼金属的冶炼采用电解法,故B错误;
C、电解熔融氯化镁可以获得金属镁,电解饱和氯化镁溶液可得氢氧化镁、氢气和氯气,故C错误;
D、Fe3O4中Fe元素化合价有+2价、+3价,1mol Fe3O4被CO全部还原成Fe时,转移8mol电子,得到9 mol铁时转移24 mol电子,故D正确;
故选D.
点评 本题考查金属的冶炼,为高频考点,金属的活泼性不同,冶炼方法不同,活泼金属采用电解法冶炼,不活泼的金属采用直接加热法冶炼,大部分金属的冶炼都是在高温下采用氧化还原反应法.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
12.下列有关元素化合物的说法正确的是( )
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,FeS2中的硫元素全部被氧化 |
4.下列图示试验正确的是( )
| A. | 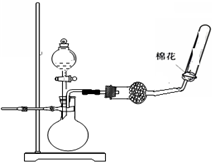 制取收集干燥氨气 | B. |  碳酸氢钠受热分解 | ||
| C. | 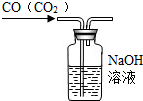 除去CO气体中的CO2气体 | D. | 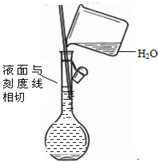 配制溶液 |
11.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 铍的氧化物对应的水化物可能具有两性 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
1.下列烃中,一卤代物的同分异构体的数目最少和最多的分别是( )
| A. | 乙烷 | B. | 2-甲基丙烷 | C. | 2,2-二甲基丙烷 | D. | 2,2-二甲基丁烷 |
8.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的氧化铜与CO的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
5.室温下测得甲醛、乙醛和丙酮组成的液态混合物中氢元素的质量分数为9.8%,则该混合物的氧元素的质量分数为( )
| A. | 52.2% | B. | 31.4% | C. | 30% | D. | 27.5% |
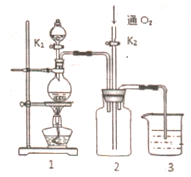 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)