题目内容
5.全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e-═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ•mol-1.
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min);
②氢气的转化率=75%;
③该反应的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是CD.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1<c2的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入氧气一极的电极反应式为O2+4e-+2H2O=4OH-;
②随着电池不断放电,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率大于(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.

分析 (1)已知:Ⅰ.H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ/mol
Ⅱ.CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ.12C3+(s)+12e-═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
根据盖斯定律,Ⅱ×6+Ⅲ+Ⅰ×6可得:6CO2(g)+6H2O(g)=C6H12O6(葡萄糖、s)+6O2(g);
(2)在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,10min平衡时甲醇浓度为0.75mol/L,二氧化碳浓度为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
①根据v=$\frac{△c}{△t}$计算v(H2);
②氢气的转化率=$\frac{氢气浓度变化量}{氢气起始浓度}$×100%;
③平衡常数是指:一定温度下,可逆反应达到平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积之比;
④A.正反应为放热反应,升高温度平衡逆向移动;
B.充入He(g),使体系压强增大,恒容条件下各组分浓度不变,平衡不移动;
C.将H2O(g)从体系中分离出去,平衡正向移动;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡正向移动;
⑤增大某一反应物的浓度,平衡正向移动,移动结果不能消除该物质浓度增大;
(3)①氧气发生还原反应,获得电子,在碱性条件下生成氢氧根离子;
②甲烷燃烧生成二氧化碳与水,二氧化碳又与氢氧化钠反应生成碳酸钠,溶液碱性减弱;
③甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高.
解答 解:(1)已知:Ⅰ.H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ/mol
Ⅱ.CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ.12C3+(s)+12e-═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
根据盖斯定律,Ⅱ×6+Ⅲ+Ⅰ×6可得:6CO2(g)+6H2O(g)=C6H12O6(葡萄糖、s)+6O2(g),则△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol,
故热化学方程式为:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ•mol-1,
故答案为:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ•mol-1;
(2)在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,10min平衡时甲醇浓度为0.75mol/L,二氧化碳浓度为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
①从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol•L-1•min-1,
故答案为:0.225;
②氢气的转化率=$\frac{2.25mol/L}{3mol/L}$×100%=75%,
故答案为:75%;
③平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
④A.因正反应放热,升高温度平衡向逆反应方向移动,则比值减小,故A错误;
B.充入He(g),使体系压强增大,恒容条件下各组分浓度不变,平衡不移动,比值不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方向移动,比值增大,故C正确;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡正向移动,则比值增大,故D正确,
故答案为:CD;
⑤加入氢气虽然正向移动,平衡移动的结果是减弱这种改变,而不能消除这种改变,即虽然平衡正向移动,氢气的物质的量在增加后的基础上减小,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变,达到新平衡时H2的物质的量浓度与之前相比一定增大,故c1<c2,故答案为:<;
(3)①氧气发生还原反应,获得电子,在碱性条件下生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②燃料电池的总反应是:CH4+2O2+2KOH═K2CO3+3H2O,消耗氢氧根离子,所以碱性减弱,pH减小,故答案为:减小;
③甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高,故答案为:大于.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、热化学方程式书写、原电池等,题目比较综合,是对学生综合能力的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | NaHCO3转化为Na2CO3 |
-CH3+2KMnO4$\stackrel{△}{→}$-COOK+KOH+2MnO2↓+H2O
-COOK+HCl→-COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
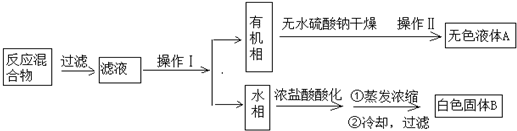
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液颜色褪去.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解,冷却结晶、过滤 | 得到白色晶体和无色溶液 | 无 |
| ② | 取少量滤液于试管中, 滴入稀HNO3和AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,测定熔点 | 白色晶体在122.4℃左右完全熔化 | 白色晶体是苯甲酸 |
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:
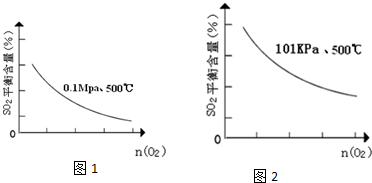
在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
