题目内容
10.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol 0~4min时,容器内气体压强为101KPa,反应过程中,SO2、O2、SO3的物质的量n (mol)的变化如下表:| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:
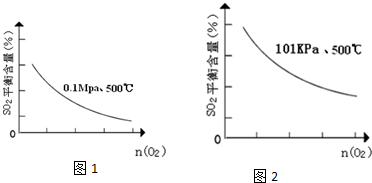
在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
分析 (1)平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积之比;
(2)各组分的浓度、物质的量保持不变时,反应处于平衡状态;
(3)由于容器的体积可变,由速率单位可知,根据v=$\frac{△n}{△t}$计算0~3min时间内用SO2表示的平均反应速率;SO2的转化率=$\frac{消耗的二氧化硫物质的量}{二氧化硫起始物质的量}$×100%;
(4)第5min时,SO2减小0.12mol,O2减小0.06mol,SO3增大0.12mol,三者变化量之比等于化学计量数之比,平衡正向移动,且前1min内反应速率速率快,由于正反应为放热反应,升高温度平衡逆向移动,故改变条件应是增大压强;
(5)氧气物质的量一定时,由于正反应为放热反应,降低温度平衡正向移动,平衡时二氧化硫的含量减小.
解答 解:(1)2SO2(g)+O2(g)?2SO3(g)的平衡常数表达式K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;
(2)由表中数据可知,3-4min及7-9min各组分的物质的量保持不变时,反应处于平衡状态,
故答案为:3min-4min及7min-9min;
(3)0~3min时间内,用SO2表示的平均反应速率为$\frac{(2-1.76)mol}{3min}$=0.08mol/min;
7minSO2的转化率=$\frac{(2-1.4)mol}{2mol}$×100%=30%,
故答案为:0.08;30%;
(4)第5min时,SO2减小0.12mol,O2减小0.06mol,SO3增大0.12mol,三者变化量之比等于化学计量数之比,平衡正向移动,且前1min内反应速率速率快,由于正反应为放热反应,升高温度平衡逆向移动,故改变条件应是增大压强,
故答案为:增大压强;正反应;
(5)氧气物质的量一定时,由于正反应为放热反应,降低温度平衡正向移动,平衡时二氧化硫的含量减小,则温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线为: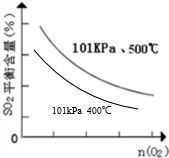 ,
,
故答案为: .
.
点评 本题考查化学平衡计算与影响因素、平衡常数、平衡状态、反应速率计算等,(3)中反应速率计算注意体积变化,不能用浓度变化量表示速率,根据题目中给出的速率单位可知用单位时间内物质的量变化量表示反应速率.

 高中必刷题系列答案
高中必刷题系列答案| A. | 溶液仍为紫色 | |
| B. | 溶液中有气泡产生,溶液最终变为无色 | |
| C. | 最终溶液褪色,而无其他现象 | |
| D. | 溶液最终变为蓝色 |
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) mol/L | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
| c(NO2) mol/L | 0.000 | 0.060 | 0.100 | 0.120 | 0.120 | 0.120 |
①反应处于平衡状态的时间是60s、80s、100s.当其他条件不变,时间为120秒时,c(NO2)=0.120mol/L.
②反应开始至60秒时,平均速率υ(N2O4 )=0.001mol/(L•s).
③对此平衡体系降低温度后,气体的颜色变浅,则正反应是吸热(填“放热”或“吸热”)反应.
④若在此反应中加入适宜的催化剂,对化学反应速率影响(填“影响”或“不影响”),对化学平衡不影响(填“影响”或“不影响”).

| A. | 该有机物在一定条件下可发生加聚反应 | |
| B. | 该有机物在一定条件下可发生银镜反应 | |
| C. | 1 mol该有机物在一定条件下可消耗2 mol Br2 | |
| D. | 1 mol该有机物最多可消耗2 mol NaOH |
| A. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,5.6 L四氯化碳(CCl4)含有的分子数为0.25NA | |
| D. | NA个一氧化碳分子和0.5 mol 甲烷的质量比为7:4 |
| A. | NH4Cl的电子式: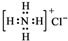 | |
| B. | Cl-的结构示意图: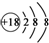 | |
| C. | 二氧化碳的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| D. | 中子数为16的硫离子:${\;}_{16}^{32}$S2- |
 已知:CH3CH2OH+NaBr+H2SO4(浓) $\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓) $\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.