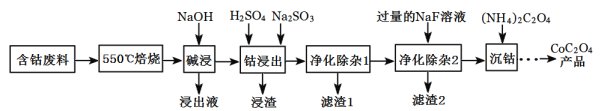
题目内容
【题目】工业炼铁过程中涉及到的主要反应有:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
回答下列问题:
(1)![]() ________
________![]() 。
。
(2)![]() 时,向容积为
时,向容积为![]() 的恒容密闭容器中加入
的恒容密闭容器中加入![]()
![]() 和
和![]()
![]() 发生反应③,5min时达到平衡,平衡时测得混合气体中
发生反应③,5min时达到平衡,平衡时测得混合气体中![]() 的体积分数为80%,则0~5min内反应的平均速率
的体积分数为80%,则0~5min内反应的平均速率![]() ________
________![]() ,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
A.固体的物质的量不再变化
B.体系的压强保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内消耗![]() 和生成
和生成![]() 的物质的量相等
的物质的量相等
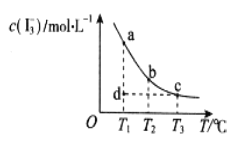
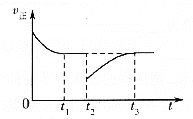
(3)一定条件下进行反应③,正向反应速率与时间的关系如图所示,![]() 时刻改变了一个外界条件,可能是________。
时刻改变了一个外界条件,可能是________。
(4)向密闭容器中加入足量的![]() 、
、![]() 和一定量的
和一定量的![]() 、
、![]() ,在
,在![]() 和
和![]() 下,反应③体系中
下,反应③体系中![]() 和
和![]() 的分压随时间变化的关系如图所示(已知温度:
的分压随时间变化的关系如图所示(已知温度:![]() )
)
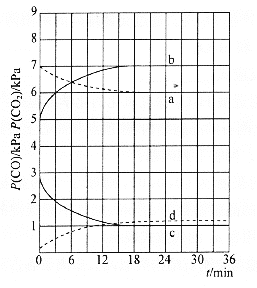
![]() 时,
时,![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时,
时,![]() 随时间变化关系的曲线是________。向
随时间变化关系的曲线是________。向![]() 时已经达到平衡状态的反应③体系中再充入一定量的
时已经达到平衡状态的反应③体系中再充入一定量的![]() ,再次达到平衡时,
,再次达到平衡时,![]() 与
与![]() 的物质的量之比为________。
的物质的量之比为________。
【答案】-28 0.048 64 AC 恒压条件下充入一定量![]() a c 1:7
a c 1:7
【解析】
(1)根据盖斯定律进行ΔH3的计算;
(2)根据题干信息,列三段式求出CO转化的物质的量,从而求出0~5min内的平均反应速率和平衡常数,根据分析“变量”来判断是否能够作为反应达到平衡的标志;
(3)结合化学反应速率和平衡移动的影响因素进行分析解答;
(4)结合第(2)中的平衡常数,根据CO和CO2的浓度比通过阿伏伽德罗定律得出三个温度下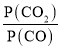 的大小关系,从而结合图像分析得出代表曲线,在根据温度不变,平衡常数不变求出比值。
的大小关系,从而结合图像分析得出代表曲线,在根据温度不变,平衡常数不变求出比值。
(1)由题干信息分析可得,反应③可通过反应![]() (④-②×3)得到,根据盖斯定律,ΔH3=
(④-②×3)得到,根据盖斯定律,ΔH3=![]() (ΔH4-3ΔH2)=
(ΔH4-3ΔH2)=![]() (460-3×172)=-28kJ·mol-1,故答案为:-28;
(460-3×172)=-28kJ·mol-1,故答案为:-28;
(2)T1时,向容积为10L的恒容密闭容器中加入3molFe2O3和3molCO发生反应③,平衡时测得混合气体中CO2的体积分数为80%,设CO转化了x mol,列三段式有:
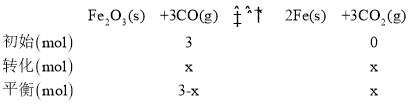
则![]() ,解得x=2.4mol,因此0~5min内反应的平均速率
,解得x=2.4mol,因此0~5min内反应的平均速率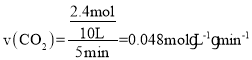 ,该温度下的平衡常数
,该温度下的平衡常数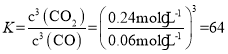 ;
;
A.由化学反应方程式可知,反应中固体的物质的量为一个变量,当固体的物质的量不再发生改变时,可以说明反应达到了平衡,A选项正确;
B.恒温恒容时,由阿伏伽德罗定律PV=nRT可知,体系的压强与气体的物质的量成正比,因为反应中气体的物质的量始终保持不变,所以体系压强始终不变,故体系的压强保持不变不能说明反应达到了平衡,B选项错误;
C.混合气体的平均摩尔质量=混合气体的总质量÷混合气体的物质的量,反应前后混合气体的总质量增加,总物质的量不变,则混合气体的平均摩尔质量为一个变量,当混合气体的平均摩尔质量保持不变时,可以说明反应达到了平衡,C选项正确;
D.单位时间内消耗CO和生成CO2都是正反应方向,不能说明反应达到了平衡,D选项错误;
答案选AC,故答案为:0.048;64;AC;
(3)由于该反应是一个反应前后气体体积不变的且正反应是放热的反应,根据图像变化趋势可知,在t2时v正减小,且重新平衡时等于原平衡的v正,平衡不移动,则改变的条件可能是在恒压条件下充入一定量的CO2气体,故答案为:在恒压条件下充入一定量的CO2气体;
(4)由(2)知,T1时,反应③的平衡常数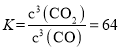 ,因为T1>T2>T3,所以T2、T3时,反应达到平衡后K3>K2>K,则达到平衡后,T3时的
,因为T1>T2>T3,所以T2、T3时,反应达到平衡后K3>K2>K,则达到平衡后,T3时的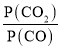 >T2时的
>T2时的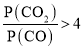 ,故曲线a表示T2时P(CO2)随时间变化的关系曲线,曲线d表示T2时P(CO)随时间变化的关系曲线,曲线b表示T3时P(CO2)随时间变化的关系曲线,曲线c表示T3时P(CO)随时间变化的关系曲线,由于温度不变,平衡常数不变,故向T3时已经达到平衡状态的反应③体系中再充入一定量的CO,再次达到平衡时,CO与CO2的物质的量之比仍为1:7,故答案为:a;c;1:7。
,故曲线a表示T2时P(CO2)随时间变化的关系曲线,曲线d表示T2时P(CO)随时间变化的关系曲线,曲线b表示T3时P(CO2)随时间变化的关系曲线,曲线c表示T3时P(CO)随时间变化的关系曲线,由于温度不变,平衡常数不变,故向T3时已经达到平衡状态的反应③体系中再充入一定量的CO,再次达到平衡时,CO与CO2的物质的量之比仍为1:7,故答案为:a;c;1:7。

【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1
B. 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C. 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10%
D. 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)减小