题目内容
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为___,G的原子结构示意图是___。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为___,所含化学键类型为___。向甲中滴加足量水时发生反应的化学方程式是___。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是___。(用离子符号表示)
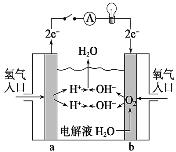
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的___极,负极的电极反应式为___。
【答案】第二周期第ⅤA族 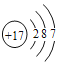
![]() 离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O=4NaOH+O2↑ r(S2-)>r(Cl-)>r(Na+) 负 CH4+10OH--8e-=CO
离子键和非极性共价键(或离子键和共价键) 2Na2O2+2H2O=4NaOH+O2↑ r(S2-)>r(Cl-)>r(Na+) 负 CH4+10OH--8e-=CO![]() +7H2O
+7H2O
【解析】
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素。
(1)C是氮元素,原子有2个电子层,最外层电子数为5,在元素周期表中的位置:第二周期第VA族,G为Cl元素,原子结构示意图是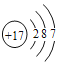 ,故答案为:第二周期第VA族;
,故答案为:第二周期第VA族;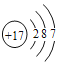 ;
;
(2)D与E按原子个数比1:1形成化合物甲为Na2O2,其电子式为![]() ,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:![]() ;离子键、共价键;2Na2O2+2H2O═4NaOH+O2↑;
;离子键、共价键;2Na2O2+2H2O═4NaOH+O2↑;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Na+,故答案为:S2->Cl->Na+;
(4)用CH4、O2和NaOH的水溶液组成燃料电池,电极材料为多孔惰性金属电极.在a极通入CH4气体,b极通入O2气体,甲烷发生氧化反应,则a极是该电池的负极,b为正极,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极的电极反应式为:O2+2H2O+4e-=4OH-,而负极甲烷失电子,在碱性环境下生成碳酸根离子,极反应方程式:CH4+10OH--8e-=CO![]() +7H2O;
+7H2O;
故答案为:负;CH4+10OH--8e-=CO![]() +7H2O;
+7H2O;

 阅读快车系列答案
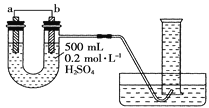
阅读快车系列答案【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO![]() +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
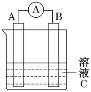
(1)该实验探究的是___因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。

(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO![]() )=___mol·L-1(假设混合液体积为50mL)。
)=___mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___来比较化学反应速率。
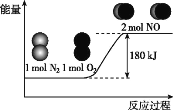
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①产物MnSO4是该反应的催化剂、②___。