题目内容
1.下列溶液中,与Cu不能发生反应的是( )| A. | 浓H2SO4(热) | B. | 浓HNO3(常温) | C. | 浓盐酸(热) | D. | 稀HNO3(热) |
分析 铜金属活泼性排在氢的后面,与非氧化性酸不反应,遇到强氧化性酸发生氧化还原反应,据此解答.
解答 解:浓H2SO 4(热)、浓HNO3(常温)、稀HNO3(热)都具有强的氧化性,一定条件下都能与Cu反应.而浓盐酸(热)为非氧化性酸,不与Cu反应,
故选C.
点评 本题考查了浓硫酸、浓硝酸性质,熟悉酸的氧化性和氧化性的酸性质的区别是解题关键,注意浓硫酸与铜反应需要加热.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烯的分子式:C2H4 | ||
| C. | 乙酸的结构简式:C2H2O2 | D. | 丙烷分子的球棍模型是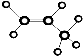 |
16.关于食品添加剂,下列说法中,正确的是( )
| A. | 为了让食品保存得更长一些,可以多加一些添加剂 | |
| B. | 在国家卫生部门规定的范围内使用食品添加剂,一般认为对人体无害 | |
| C. | 染衣服的染料也可以用给食品染色 | |
| D. | 某腌制的肉类颜色鲜红,说明该食品既新鲜又安全 |
13.下列各组物质的晶体中,所含化学键类型全部相同,熔化时所克服的作用力也完全相同是( )
| A. | CO2和SiO2 | B. | NaCl和HCl | ||
| C. | (NH4)2CO3和CO(NH2)2 (尿素) | D. | NaH和KCl |
10.蛇纹石由MgO、A12O3、SiO2、Fe2O3组成.现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 从蛇纹石组成看,其成分皆是碱性氧化物 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 |

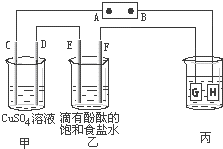 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.