题目内容
13.下列各组物质的晶体中,所含化学键类型全部相同,熔化时所克服的作用力也完全相同是( )| A. | CO2和SiO2 | B. | NaCl和HCl | ||
| C. | (NH4)2CO3和CO(NH2)2 (尿素) | D. | NaH和KCl |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键,不同类型的晶体的作用力不同,以此解答该题.
解答 解:A.都含有共价键,但CO2为分子晶体,SiO2为原子晶体,熔化时分别克服分子间作用力和共价键,故A错误;
B.NaCl为离子化合物,含有离子键,HCl为共价化合物,含有共价键,故B错误;
C.(NH4)2CO3为离子化合物,含有离子键,CO(NH2)2 (尿素)为共价化合物,含有共价键,故C错误;
D.NaH和KCl都为离子化合物,熔化时都克服离子键,故D正确.
故选D.
点评 本题以微粒间作用力为载体考查晶体类型,侧重考查学生对这几种晶体类型的判断能力,为高频考点,注意把握晶体类型的判断,难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
4.下列储存药品的方法中,正确的是( )
| A. | 氢氟酸保存在玻璃试剂瓶中 | B. | 氯水保存在棕色试剂瓶中 | ||
| C. | 金属钠保存在无水酒精中 | D. | 浓硝酸保存在无色试剂瓶中 |
1.下列溶液中,与Cu不能发生反应的是( )
| A. | 浓H2SO4(热) | B. | 浓HNO3(常温) | C. | 浓盐酸(热) | D. | 稀HNO3(热) |
18.能除去CH4中少量CH2═CH-CH3的最好方法是( )
| A. | 通入足量溴水中 | B. | 点燃 | ||
| C. | 催化加氢 | D. | 通入足量酸性KMnO4溶液中 |
2.把a mol C2H4跟b mol H2混合在密闭容器中,在适当条件下,反应达到平衡时生成p molC2H6,若将所得平衡混和气体完全燃烧生成二氧化碳和水,需要氧气的量是( )
| A. | (3a+b)mol | B. | (3a+$\frac{b}{2}$)mol | C. | (3a+3p+$\frac{b}{2}$)mol | D. | (3a+$\frac{b}{2}$-3p)mol |

 ,写出戊的电子式
,写出戊的电子式 ;
; NaHCO3+NaOH;(用化学反应方程式表示)
NaHCO3+NaOH;(用化学反应方程式表示)

 反应类型为氧化反应.
反应类型为氧化反应. )的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有
)的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有 )为原料可以合成聚酯PTT,写出其化学方程式
)为原料可以合成聚酯PTT,写出其化学方程式 .
.
 ,请你设计出合理的反应流程图
,请你设计出合理的反应流程图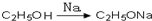 、
、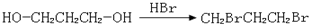 、
、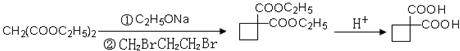 .提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …
.提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …